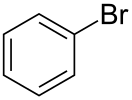
Бромбензол
Бромбензол (фенилбромид) — галогенпроизводное бензола, ароматическое органическое соединение, имеющее формулу C6H5Br, бесцветная жидкость (часто слегка желтоватого цвета из-за различных примесей) с характерным сладковатым запахом.
| Бромбензол | |||
|---|---|---|---|
 | |||
| Общие | |||
| Хим. формула | C6H5Br | ||
| Физические свойства | |||
| Молярная масса | 157,01 г/моль | ||
| Плотность | 1,495 г/см³ | ||
| Энергия ионизации | 8,98 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -30.8 °C | ||
| • кипения | 156 °C | ||
| Структура | |||
| Дипольный момент | 5,7E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 108-86-1 | ||
| PubChem | 7961 | ||
| Рег. номер EINECS | 203-623-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | CY9000000 | ||
| ChEBI | 3179 | ||
| ChemSpider | 7673 | ||
| Безопасность | |||
| Предельная концентрация | 3 мг/м³ | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение править
Бромбензол получают в реакции бензола с бромом в присутствии FeBr3. Побочным продуктом является HBr. [2]
- C6H6 + Br2 = C6H5Br + HBr
Применение править
Бромбензол используется для приготовления соответствующего реактива Гриньяра, фенилмагнийбромида C6H5MgBr.
- C6H5Br + Mg = C6H5MgBr
Фенилмагнийбромид является важным реагентом для введения фенильной группы в различные соединения (альдегиды, кетоны и их производные).
Реагент со схожими свойствами, фениллитий C6H5Li, получается в реакции бромбензола с бутиллитием или металлическим литием.
- C6H5Br + 2Li = C6H5Li + LiBr
- C6H5Br + C4H9Li = C6H5Li + C4H9Br
Также бромбензол применяется в катализируемых палладием реакциях кросс-сочетания, например, в реакции Сузуки.
Токсичность править
В экспериментах на животных ЛК50 бромбензола определена в 21 г/м³, ЛД50 для мышей — 2,7 г/кг, для крыс 3,2 г/кг, для кроликов 3,3 г/кг, для морских свинок 1,7 г/кг. ПДК установлена в 3 мг/м³[3]
См. также править
Примечания править
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Бромирование бензола Архивная копия от 25 марта 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Беспамятнов, Г. П. Предельно допустимые концентрации химических веществ в окружающей среде / Г. П. Беспамятнов, Ю. А. Кротов. — Л. : Химия, 1985. — С. 34. — 528 с. : ил. — ББК 604. — УДК (614.71+614.777)/083(G).
Литература править
- Григорович П. С. Бромбензолы // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |