Сульфа́т меди(II) (медь(II) серноки́слая, традиционное название кристаллогидрата — ме́дный купоро́с) — неорганическое соединение, медная соль серной кислоты с формулой CuSO4.
| Сульфат меди(II) | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Сульфат меди(II) |
| Традиционные названия | пентагидрат: «медный купорос» |
| Хим. формула | CuSO4 |
| Рац. формула | CuSO4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5[1] |
| Термические свойства | |
| Температура | |
| • плавления | 200 °C[2] |
| • разложения | выше 650 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 5⋅10−3 |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура |
безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| InChI | |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| Безопасность | |
| Предельная концентрация | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 | мыши, орально: 87 мг/кг |
| Токсичность | Умеренно токсичен, ирритант, опасен для окружающей среды |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |

Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего. На воздухе постепенно выветриваются (теряют кристаллизационную воду). Имеет горьковато-металлический вяжущий вкус.
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется в виде голубого пентагидрата CuSO4·5H2O (медный купоро́с). Токсичность медного купороса для теплокровных животных относительно невысока, в то же время он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Нахождение в природе
правитьВ природе встречается в виде минералов халькантита (CuSO4·5H2O), халькокианита (CuSO4), бонаттита (CuSO4·3H2O), бутита (CuSO4·7H2O) и в составе некоторых других минералов[5].
Получение
правитьВ промышленности
правитьВ промышленности загрязнённый сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании раствора воздухом:
растворением оксида меди(II) CuO в H2SO4:
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях
правитьВ лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
Также в лабораторных условиях сульфат меди(II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл концентрированной азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности плёнки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 раза перекристаллизовать из дистиллированной воды и высушить[6].
Очистка
правитьОчистить загрязнённый или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространённой примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности плёнки кристаллов, после чего охлаждают для кристаллизации[6].
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ»[6].
Глубокая очистка
правитьСуществует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10-4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2—3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3—5 граммов, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3-х процентного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов[7].
Физические свойства
править| Температура, °С |
Растворимость | ||
|---|---|---|---|
| % | % | в г на 100 г воды | |
| 0 | 12,9 | 20,2 | 23,3 |
| 15 | 16,2 | 25,3 | 30,2 |
| 25 | 18,7 | 29,2 | 34,9 |
| 30 | 20,3 | 31,6 | 39,9 |
| 40 | 22,8 | 35,5 | 46,2 |
| 50 | 25,1 | 39,2 | 52,6 |
| 60 | 28,1 | 43,8 | 61,1 |
| 70 | 31,4 | 49,0 | 71,6 |
| 80 | 34,9 | 54,4 | 83,8 |
| 90 | 38,9 | 60,0 | 98,2 |
| 100 | 42,4 | 66,0 | 115,0 |
Пентагидрат сульфата меди(II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см3. При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание[9].
Растворимость в воде
правитьРастворимость сульфата меди(II) в воде при разных температурах приведена в таблице.
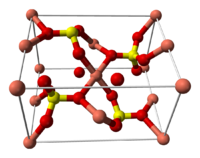
Строение кристаллогидрата
правитьСтруктура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO42− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие
правитьПри нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
Реакция гидратации безводного сульфата меди(II) экзотермическая и проходит со значительным выделением тепла (79 кДж/моль).
Химические свойства
правитьЭлектролитическая диссоциация
правитьКак и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10−3.
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) диссоциирует в одну стадию:
Реакция замещения
правитьРеакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее меди, стоящих левее меди в электрохимическом ряду напряжения металлов:
Реакция с растворимыми основаниями (щелочами)
правитьСульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета[10]:
Сокращённое ионное уравнение (Правило Бертолле)
правитьРеакция обмена с другими солями
правитьСульфат меди вступает также в обменные реакции по ионам Cu2+ и SO42-:
Окислительные свойства
правитьСульфат меди окисляет HI, йодиды и при нагревании HBr и бромиды до свободных галогенов. Восстанавливается йодоводородом и йодидами до металлической меди при освещении, так как образующийся иодид меди(I) разлагается на свету. Смесь сухих сульфата меди и бромида натрия из-за образования бромида меди(II), который в сухом состоянии разлагается при температуре выше +500°C, а в присутствии влаги снижается его температура разложения до 115-140°C:
Прочее
правитьС сульфатами щелочных металлов и аммония образует комплексные соли, например: Na2[Cu(SO4)2]·6H2O.
Ион Cu2+ окрашивает пламя в зелёный цвет.
Производство и применение
правитьСульфат меди(II) — одна из важнейших солей меди. Часто служит исходным сырьём для получения других соединений меди.
Безводный сульфат меди — хороший влагопоглотитель и может быть использован для обезвоживания (абсолютирования) этанола, осушения газов (в том числе воздуха) и как индикатор влажности.
Лёгкость выращивания кристаллов пентагидрата сульфата меди и их резкое различие с безводной формой используются в школьном образовании.
В машиностроении используется для окраски металлических деталей перед их ручной разметкой.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей, а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. Для обеззараживания ран деревьев используется 1 %-ный раствор (100 г на 10 л), который втирается в предварительно зачищенные повреждённые участки. Против фитофтороза томатов и картофеля производятся опрыскивания посадок 0,2 % раствором (20 г на 10 л) при первых признаках заболевания, а также для профилактики при угрозе возникновения болезни (например, в сырую влажную погоду). Раствором сульфата меди поливается почва для обеззараживания и восполнения недостатка серы и меди (5 г на 10 л). Однако чаще медный купорос применяется в составе бордо́ской жидкости — основного сульфата меди CuSO4·3Cu(OH)2 против грибковых заболеваний и виноградной филлоксеры. Для этих целей сульфат меди(II) имеется в розничной торговле.
Для борьбы с цветением воды в водохранилищах также используется химическая обработка медным купоросом[11].
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и в составе прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В быту применяют для выведения пятен ржавчины на потолке после затоплений.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Безопасность
правитьВещество малотоксично. ПДК 500 мг/л[12][13]. Смертельная доза медного купороса составляет от 45 до 125 граммов для взрослого человека перорально (при проглатывании), в зависимости от массы, состояния здоровья, иммунитета к избытку меди и от других факторов. Признаки отравления становятся заметными при разовом потреблении более 0,5 г соединения внутрь (т. н. токсическая доза). LD50 для крыс 300 мг/кг[3]. Картина отравления при вдыхании аэрозолей медного купороса более сложна.
Правила обращения с веществом
правитьПопадание на кожу сухого вещества считается безопасным, но его необходимо смыть. Аналогично при попадании растворов и увлажнённого твердого вещества. При попадании в глаза необходимо обильно промыть их проточной водой (слабой струёй). При попадании в желудочно-кишечный тракт твердого вещества или концентрированных растворов необходимо промыть желудок пострадавшего 0,1 % раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1—2 ложки, вызвать рвоту, дать мочегонное. Кроме того, попадание в рот и желудок безводного вещества может вызвать термические ожоги.
Слабые растворы сульфата меди при приёме внутрь действуют как сильное рвотное средство и иногда применяются для провоцирования рвоты.
При работе с порошками и пылью сульфата меди, следует соблюдать осторожность и не допускать их пыления, необходимо использовать маску или респиратор, а после работы вымыть лицо. Острая токсическая доза при вдыхании аэрозоля — 11 мг/кг[14]. При попадании сульфата меди через дыхательные пути в виде аэрозоля нужно вывести пострадавшего на свежий воздух, прополоскать рот водой и промыть крылья носа.
Хранить вещество следует в сухом прохладном месте, в плотно закрытой жёсткой пластиковой или стеклянной упаковке, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте.
Гигиенические нормативы
правитьПДК в рабочей зоне — 1 мг/л (1г/м³) (по ионам двухвалентной меди).
Примечания
править- ↑ Медный купорос. kristallov.net. Дата обращения: 26 апреля 2017. Архивировано 9 мая 2017 года.
- ↑ David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 Ершов Ю. А., Плетнева Т. В. Механизмы токсического действия неорганических соединений. — М.: Медицина, 1989. — С. 142.
- ↑ Cupric sulfate Архивная копия от 12 августа 2014 на Wayback Machine. US National Institutes of Health
- ↑ Меди сульфат // Химическая энциклопедия / Гл. ред. И. Л. Кнунянц, Н. С. Зефиров. — М.: Советская энциклопедия, 1990. — Т. 3. — ISBN 5-85270-008-8.
- ↑ 1 2 3 Карякин Ю. В. Чистые химические реактивы. Руководство по лабораторному приготовлению неорганических препаратов. — 2-е изд. — М.—Л.: ГХИ, 1947. — С. 343. — 577 с.
- ↑ Полянский Н. А., Кожевник С. Н. Очистка соединений меди от примесей. Приготовление сульфата меди высокой чистоты // Сборник лабораторных работ. — Норильск, 1998.
- ↑ Вассерман И. М. Производство минеральных солей. — Издание 2-е изд., перераб. и доп.. — Ленинград: Госхимиздат. Ленингр. отд-ние, 1962. — 439 с.: ил. с. Архивировано 26 июля 2020 года.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.—М.: Химия, 1963. — Т. 2. — С. 124—125, 265. — 1168 с. — 20 000 экз. Архивировано 16 октября 2012 года.
- ↑ Получение нерастворимых оснований. Единая коллекция ЦОР. Дата обращения: 26 апреля 2017. Архивировано 26 апреля 2017 года.
- ↑ Сельскохозяйственное водоснабжение и обводнение. — Колос. — М., 1984.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 19347-2014 Купорос медный. Технические условия (Издание с поправкой)
- ↑ name=https://www.safework.ru Архивная копия от 8 марта 2022 на Wayback Machine
- ↑ Copper Sulfate (англ.). Pesticide Management Education Program (PMEP). Cornell University (декабрь 1993). Дата обращения: 26 апреля 2017. Архивировано 5 июля 2019 года.

