Монобромид иода
Монобромид иода — бинарное неорганическое соединение иода и брома с формулой IBr, чёрно-коричневые кристаллы, реагирует с водой.
| Монобромид иода | |
|---|---|
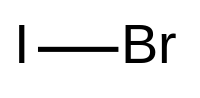 | |
| Общие | |
| Систематическое наименование |
Бромид иода |
| Традиционные названия | Бромистый иод |
| Хим. формула | IBr |
| Рац. формула | IBr |
| Физические свойства | |
| Состояние | чёрно-коричневые кристаллы |
| Молярная масса | 206,81 г/моль |
| Плотность | 4,416 г/см³ |
| Энергия ионизации | 9,79 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 36; 40,5 °C |
| • кипения | с разл. 116 °C |
| Структура | |
| Дипольный момент | 2,4E−30 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 7789-33-5 |
| PubChem | 82238 |
| Рег. номер EINECS | 232-159-9 |
| SMILES | |
| InChI | |
| ChemSpider | 74216 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение править
Физические свойства править
Монобромид иода образует чёрно-коричневые кристаллы ромбической сингонии, пространственная группа C cm21, параметры ячейки a = 0,490 нм, b = 0,699 нм, c = 0,893 нм, Z = 4.
Растворяется в этаноле, сероуглероде, хлороформе и диэтиловом эфире.
Химические свойства править
- Обратимо разлагается при нагревании выше температуры плавления:
- Реагирует с холодной водой:
- и горячей:
- Реагирует с горячей серной кислотой:
- Реагирует с щелочами:
- С бромидами тяжёлых щелочных металлов образует комплексы:
Токсикология править
Бромид иода(I) IBr особо токсичен. Сильнейший окислитель. Опасно реагирует с водой.
Литература править
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
