Ксиленоловый оранжевый
Ксиленоловый оранжевый — индикатор, применяемый при комплексонометрическом титровании.
| Ксиленоловый оранжевый | |
|---|---|
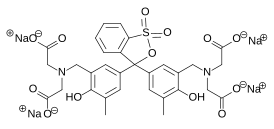 | |
| Общие | |
| Хим. формула | C31H28N2Na4O13S |
| Физические свойства | |
| Молярная масса | 760.59 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 222 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 200 г/100 мл |
| Классификация | |
| Рег. номер CAS | 3618-43-7 |
| PubChem | 73041 |
| Рег. номер EINECS | 216-553-8 |
| SMILES | |
| InChI | |
| ChemSpider | 65838 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ксиленоловый оранжевый представляет собой красно-коричневые кристаллы, растворимые в воде и нерастворимые в этаноле, диэтиловом эфире и ацетоне. Его синтезируют методом аминометилирования крезолового красного формальдегидом и иминодиуксусной кислоты в среде уксусной кислоты.
В основном используется как металлохромный индикатор (переход окраски от красной к жёлтой) для прямого комплексонометрического определения ионов цинка, кальция, кадмия, меди(II), железа(III), марганца(II)), никеля(II), свинца(II), а также некоторые редкоземельных элементов; для обратного титрования — ионов тория, висмута, таллия, цинка, алюминия; как реагент для спектрофотометрического определения некоторых металлов — ниобия, циркония, галлия; как кислотно-основный индикатор (переход окраски в диапазоне pH 5,4-7,4 от жёлтой к красно-фиолетовой. Титрование можно проводить трилоном Б (этилендиаминтетрауксусная кислота).
Литература править
- Тикунова И. В., Артеменко А. И., Малеванный В. А. Справочник молодого лаборанта-химика. — М.:Высш. Шк., 1985. — стр. 175
- Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.
См. также править
Это заготовка статьи об органическом веществе. Помогите Википедии, дополнив её. |
