Тиоуксусная кислота
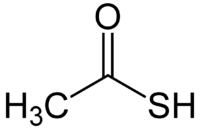
Тиоуксусная кислота — сераорганическое соединение с молекулярной формулой CH3COSH. Представляет собой жидкость жёлтого цвета с сильным тиоловым запахом. Используется в органическом синтезе для введения тиильных групп в молекулы[1], а также для получения тиолов.
| Тиоуксусная кислота | |||
|---|---|---|---|
 | |||
| |||
| Общие | |||
| Систематическое наименование |
Этантиовая S-кислота | ||
| Традиционные названия | Тиоуксусная S-кислота | ||
| Хим. формула | C2H4OS | ||
| Рац. формула | CH3COSH | ||
| Внешний вид | Желтоватая жидкость | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Примеси | Уксусная кислота, вода | ||
| Молярная масса | 76,11756 г/моль | ||
| Плотность | 1,064 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | – 58 °C | ||
| • кипения | + 93 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 3,4 | ||
| Оптические свойства | |||
| Показатель преломления | 1,462 | ||
| Классификация | |||
| Рег. номер CAS | 507-09-5 | ||
| PubChem | 10484 | ||
| Рег. номер EINECS | 208-063-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | AJ5600000 | ||
| ChEBI | 46800 | ||
| ChemSpider | 10052 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Синтез и свойства править
Тиоуксусную кислоту можно получить реакцией уксусного ангидрида с сероводородом в отсутствие следов воды[2]:
В этом случае тиоуксусная кислота будет загрязнена уксусной кислотой, и получаемую смесь требуется разделить посредством ректификации.
Относительно чистая тиоуксусная кислота может быть получена действием пентасульфида фосфора на ледяную уксусную кислоту[3]:
Соединение существует исключительно как тиоловый таутомер, что связано с высокой прочностью двойной связи C=O, гораздо более прочной, чем связь S-H, что не позволяет атому водорода мигрировать к атому кислорода.
Температура кипения данного соединения составляет +93 °C, а температура плавления — −58 °C, что на 20 и 75 К ниже (соответственно), чем аналогичные свойства для уксусной кислоты. Данный факт отражает менее интенсивное взаимодействие между молекулами тиоуксусной кислоты по сравнению с уксусной кислотой (см. водородные связи).
Реакционная способность править
Кислотность править
pKa тиоуксусной кислоты равно около 3,4[4]. Кислотный остаток представляет собой тиоацетат:
В воде при стандартных условиях тиоуксусная кислота достаточно сильно ионизирована.
Реакционная способность тиоацетата править
Бо́льшая часть реакционной способности тиоуксусной кислоты возникает из-за сопряжённого основания — тиоацетата. Соли этого аниона, например, тиоацетат калия, используются для получения эфиров тиоацетата[5]. Тиоацетатные эфиры гидролизуются с образованием тиолов. Типичный метод получения тиола из алкилгалогенида с использованием тиоуксусной кислоты включает четыре отдельных этапа, некоторые из которых можно проводить последовательно в одной и той же колбе:
- , где X = Cl, Br, I.
В приложении, которое иллюстрирует склонность тиоуксусной кислоты к радикальному присоединению, видно, что соединение реагирует с азобисизобутиронитрилом в нуклеофильном присоединении, опосредованном свободными радикалами, к экзоциклическому алкену, образуя тиоэфир[6]:
Восстановительное ацетилирование править
Соли тиоуксусной кислоты, такие как тиоацетат калия, можно использовать для одностадийного превращения нитроаренов в арилацетамиды. Это особенно полезно при получении некоторых фармацевтических препаратов, например, при получении парацетамола[7].
Примечания править
- ↑ Jeannie R. Phillips. Thiolacetic Acid (англ.) // Encyclopedia of Reagents for Organic Synthesis / John Wiley & Sons, Ltd. — Chichester, UK: John Wiley & Sons, Ltd, 2001-04-15. — P. rt096. — ISBN 978-0-471-93623-7, 978-0-470-84289-8. — doi:10.1002/047084289x.rt096.
- ↑ THIOLACETIC ACID // Organic Syntheses. — 1951. — Т. 31. — С. 105. — doi:10.15227/orgsyn.031.0105. Архивировано 18 декабря 2021 года.
- ↑ Thioacetic Acid 507-09-5 // Sax's Dangerous Properties of Industrial Materials. — Hoboken, NJ, USA: John Wiley & Sons, Inc., 2004-10-15. — ISBN 0-471-70134-3, 978-0-471-70134-7.
- ↑ Matthys J. Janssen. Thiolo, thiono and dithio acids and esters (англ.) // Carboxylic Acids and Esters (1969) / Saul Patai. — Chichester, UK: John Wiley & Sons, Ltd., 1969-01-01. — P. 705–764. — ISBN 978-0-470-77109-9, 978-0-471-66919-7. — doi:10.1002/9780470771099.ch15.
- ↑ Vuthichai Ervithayasuporn, Thapakorn Tomeechai, Nobuhiro Takeda, Masafumi Unno, Arada Chaiyanurakkul. Synthesis and Characterization of Octakis(3-propyl ethanethioate)octasilsesquioxane (англ.) // Organometallics. — 2011-09-12. — Vol. 30, iss. 17. — P. 4475–4478. — ISSN 1520-6041 0276-7333, 1520-6041. — doi:10.1021/om200477a. Архивировано 17 декабря 2019 года.
- ↑ László Lázár, Magdolna Csávás, Anikó Borbás, Gyöngyi Gyémánt, András Lipták. Synthesis of methyl 6-deoxy-4-O-(sodium sulfonato)-α-L-talopyranoside, its C-4 epimer and both isosteric [4-C-(potassium sulfonatomethyl) derivatives] // Arkivoc. — 2004-04-13. — Т. 2004, вып. 7. — С. 196–207. — ISSN 1551-7012. — doi:10.3998/ark.5550190.0005.716.
- ↑ Apurba Bhattacharya, Vikram C. Purohit, Victor Suarez, Ritesh Tichkule, Gaurang Parmer. One-step reductive amidation of nitro arenes: application in the synthesis of Acetaminophen™ (англ.) // Tetrahedron Letters. — 2006-03. — Vol. 47, iss. 11. — P. 1861–1864. — doi:10.1016/j.tetlet.2005.09.196. Архивировано 30 июня 2018 года.


