Оксид кобальта(II,III)
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 августа 2019 года; проверки требуют 6 правок.
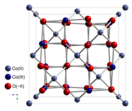
Оксид кобальта(II,III) — неорганическое соединение, оксид металла кобальта с формулой Co3O4, серо-чёрные кристаллы, не растворимые в воде. Может рассматриваться как смешанный окисел CoO•Co2O3 или как соль кобальтат(III) кобальта(II) Co[Co2O4].
| Оксид кобальта(II,III) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Оксид кобальта(II,III) | ||
| Традиционные названия | окись кобальта | ||
| Хим. формула | Co3O4 | ||
| Физические свойства | |||
| Состояние | серо-чёрные кристаллы | ||
| Молярная масса | 240,80 г/моль | ||
| Плотность | 6,073 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | разл. 900 °C | ||
| Мол. теплоёмк. | 122,8 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -887 кДж/моль | ||
| Классификация | |||
| Рег. номер CAS | 1308-06-1 | ||
| PubChem | 11651651 | ||
| Рег. номер EINECS | 215-157-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | GG2500000 | ||
| ChemSpider | 9826389 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение править
- Окисление кобальта или оксида кобальта(II) на воздухе:
- Разложение метагидроксида кобальта при нагревании:
Физические свойства править
Оксид кобальта(II,III) образует серо-чёрные кристаллы кубической сингонии, пространственная группа F d3m, параметры ячейки a = 0,8124 нм, Z = 8.
В зависимости от способа получения состав может отличаться от стехиометрического.
Является парамагнетиком.
Не растворяется в воде, р ПР = 99,15.
Химические свойства править
- Разлагается при нагревании:
- Медленно растворяется в концентрированных кислотах:
- При сплавлении с щелочами окисляется кислородом::
- Восстанавливается водородом:
Литература править
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.—Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
Это заготовка статьи о неорганическом веществе. Помогите Википедии, дополнив её. |