Контрольная точка мейотической рекомбинации
Контрольная точка мейотической рекомбинации отслеживает мейотическую рекомбинацию во время мейоза и блокирует вход в метафазу I, если рекомбинация не обрабатывается эффективно.
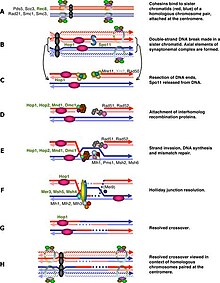
Регуляция клеточного цикла мейоза проходит аналогично регуляции митоза. Как и в митотическом цикле, эти переходы регулируются комбинациями различных факторов регуляции генов, комплексом циклин-Cdk и комплексом, способствующим анафазе (APC)[1]. Первый крупный регуляторный переход происходит в конце G1, когда начало мейотического цикла активируется Ime1 вместо Cln3/Cdk1 в митозе. Второй крупный переход происходит при вступлении в метафазу I. Основная цель этого шага — убедиться, что репликация ДНК завершилась без ошибок, чтобы тела полюсов веретена могли разделиться. Это событие запускается активацией M-Cdk в поздней профазе I. Затем контрольная точка сборки веретена исследует прикрепление микротрубочек к кинетохорам с последующей инициацией метафазы I с помощью APCCdc20. Особое разделение хромосом в мейозе, разделение гомологичных хромосом в мейозе I и разделение хроматид в мейозе II требует особого напряжения между гомологичными хроматидами и негомологичными хроматидами для различения прикрепления микротрубочек и зависит от запрограммированного двухцепочечного разрыва ДНК (DSB) и восстановления. в профазе I. Следовательно, контрольная точка мейотической рекомбинации может быть своего рода реакцией на повреждение ДНК в определённый момент времени. С другой стороны, контрольная точка мейотической рекомбинации также гарантирует, что мейотическая рекомбинация действительно происходит в каждой паре гомологов.
DSB-зависимый путь
правитьРезкое начало M-Cdk в поздней профазе I зависит от положительной петли обратной связи регуляции транскрипции, состоящей из Ime2, Ndt80 и комплекса Cdk/циклин. Однако активация M-Cdk контролируется общим переключателем фосфорилирования Wee1/Cdc25. Активность Wee1 высока в ранней профазе I, и накопление Cdc25 активирует M-Cdk путем прямого фосфорилирования и маркировки Wee1 для деградации. Мейотическая рекомбинация может начинаться с двухцепочечного разрыва, либо индуцированного Spo11[2], либо другими эндогенными или экзогенными причинами повреждения ДНК. Эти разрывы ДНК должны быть репарированы до метафазы I, и эти DSB должны быть репарированы до метафазы I. Клетки контролируют эти DSB через путь ATM, в котором Cdc25 подавляется при обнаружении повреждения DSB. Этот путь аналогичен классическому ответу на повреждение ДНК, и это часть, которую мы знаем лучше всего в контрольной точке мейотической рекомбинации.
DSB-независимый путь
правитьDSB-независимый путь был обнаружен, когда люди изучали мутантные клетки spo11 у некоторых видов и обнаружили, что эти клетки Spo11 не могут процессироваться в метафазу I даже в отсутствие DSB[3]. Прямой целью этих DSB является помощь в конденсации хромосом. Несмотря на то, что начальное связывание гомологов в ранней лептотене представляет собой просто случайные взаимодействия, дальнейшая прогрессия в пресинаптическое выравнивание зависит от образования двухцепочечных разрывов и одноцепочечных комплексов переноса[1][4]. Поэтому несинапсированные хромосомы в клетках Spo11 могут быть мишенью контрольной точки. Было обнаружено, что ААА-аденозинтрифосфатаза (ААА-АТФаза) играет важную роль в этом пути[5], но механизм ещё не ясен. Некоторые другие исследования также привлекли внимание к формированию половых тел, и передача сигналов могла быть либо структурной, либо регуляцией транскрипции, такой как мейотическая инактивация половых хромосом[6][7]. В рамках этого каскада нарушение синапса будет поддерживать экспрессию генов из половых хромосом, а некоторые продукты могут ингибировать прогрессирование клеточного цикла. Инактивация мейотической половой хромосомы происходит только у мужчин, что может частично быть причиной того, что только мутантные сперматоциты Spo11, но не ооциты, не могут перейти из профазы I в метафазу I[3][8]. Однако асинапсис происходит не только внутри половых хромосом, и такая регуляция транскрипции была приостановлена до тех пор, пока она не распространилась на все хромосомы в виде мейотического молчания несинапсированного хроматина[9], но эффекторный ген ещё не обнаружен.
Протеинкиназы контрольных точек мейоза CHEK1 и CHEK2
правитьЦентральная роль в мейозе человеческих и мышиных CHEK1 и CHEK2 и их ортологов у Saccharomyces cerevisiae, Caenorhabditis elegans, Schizosaccharomyces pombe и Drosophila была рассмотрена MacQueen и Hochwagen[10] и Subramanian и Hochwagen[11]. Во время мейотической рекомбинации у человека и мыши протеинкиназа CHEK1 важна для интеграции восстановления повреждений ДНК с остановкой клеточного цикла[12]. CHEK1 экспрессируется в семенниках и ассоциируется с мейотическими синаптонемными комплексами на стадиях зигонемы и пахинемы[12]. CHEK1, вероятно, действует как интегратор сигналов ATM и ATR и при мониторинге мейотической рекомбинации[12]. В мышиных ооцитах CHEK1, по-видимому, необходим для остановки профазы I и для функционирования в контрольной точке G2/M[13].
CHEK2 регулирует ход клеточного цикла и сборку веретена во время созревания ооцитов мыши и раннего развития эмбриона[14]. Хотя CHEK2 является нижестоящим эффектором киназы ATM, который реагирует в первую очередь на двухцепочечные разрывы, он также может активироваться киназой ATR (атаксия-телеангиэктазия и Rad3), которая реагирует в первую очередь на одноцепочечные разрывы. У мышей CHEK2 необходим для наблюдения за повреждением ДНК в мейозе самок. Реакция ооцитов на повреждение двухцепочечного разрыва ДНК включает иерархию путей, в которой киназа ATR передает сигнал CHEK2, который затем активирует белки p53 и p63[15].
У плодовой мушки дрозофилы облучение клеток зародышевой линии вызывает двухцепочечные разрывы, которые приводят к остановке клеточного цикла и апоптозу. Ортолог mnk CHEK2 дрозофилы и ортолог p53 dp53 необходимы для большей части гибели клеток, наблюдаемой в раннем оогенезе, когда происходят отбор ооцитов и мейотическая рекомбинация[16].
Специфический для мейоза фактор транскрипции Ndt80
правитьNdt80 является специфичным для мейоза транскрипционным фактором, необходимым для успешного завершения мейоза и образования спор[17]. Белок распознает и связывается со средним элементом спорообразования (MSE) 5'-C[AG]CAAA[AT]-3' в промоторной области специфических для стадии генов, которые необходимы для прохождения мейоза и спорообразования[17][18][19]. Был выделен ДНК-связывающий домен Ndt80, и его структура показывает, что этот белок является членом Ig-складчатого семейства транскрипционных факторов[20]. Ndt80 также конкурирует с репрессором SUM1 за связывание с промоторами, содержащими MSE[21].
Переходы в дрожжах
правитьКогда мутация инактивирует Ndt80 у почкующихся дрожжей, мейотические клетки демонстрируют длительную задержку поздней пахитены, третьей стадии профазы[22]. Клетки демонстрируют интактные синаптонемные комплексы, но в конечном итоге останавливаются на стадии диффузного хроматина, следующей за пахитеной. Эта остановка, опосредованная контрольной точкой, предотвращает возникновение более поздних событий до тех пор, пока более ранние события не будут успешно выполнены, и предотвращает неправильную сегрегацию хромосом[23][24].
Роль в развитии клеточного цикла
правитьNDt80 имеет решающее значение для завершения профазы и вступления в мейоз 1, поскольку стимулирует экспрессию большого количества генов среднего мейоза. Ndt80 регулируется через транскрипционные и посттрансляционные механизмы (то есть фосфорилирование).
Взаимодействие с Clb1
правитьNdt80 стимулирует экспрессию циклина Clb-1 B-типа, который сильно взаимодействует с Cdk1 во время мейотических делений[25]. Активные комплексы Clb-1 с Cdk1 играют большую роль в запуске событий первого мейотического деления, и их активность ограничена мейозом 1[26].
Взаимодействие с Ime2
правитьNdt80 стимулирует экспрессию самого себя и экспрессию протеинкиназы Ime2, которые по обратной связи дополнительно стимулируют Ndt80. Это повышенное количество белка Ndt80 дополнительно усиливает транскрипцию генов-мишеней[24]. В начале мейоза 1 активность Ime2 повышается и необходима для нормального накопления и активности Ndt80. Однако, если Ndt80 экспрессируется преждевременно, он первоначально будет накапливаться в немодифицированной форме. Затем Ime2 может также действовать как специфичная для мейоза киназа, которая фосфорилирует Ndt80, что приводит к полностью активированному Ndt80[27].
Выражение Plk
правитьNdt80 стимулирует экспрессию гена, кодирующего полоподобную киназу, Plk. Этот белок активируется в поздней пахитене и необходим для образования кроссовера и частичной потери сцепления плеч хромосом. Plk также необходим и достаточен для запуска выхода из пахитенных точек[28][29].
Модель рекомбинации
правитьКонтрольная точка мейотической рекомбинации работает в ответ на дефекты мейотической рекомбинации и хромосомного синапса, потенциально останавливая клетки перед вступлением в мейотические деления[30]. Поскольку рекомбинация инициируется двухцепочечными разрывами (DSB) в определённых областях генома, вступление в мейоз 1 должно быть отложено до тех пор, пока DSB не будут репарированы[31]. Специфичная для мейоза киназа Mek1 играет важную роль в этом, и недавно было обнаружено, что Mek1 способна фосфорилировать Ndt80 независимо от IME2. Это фосфорилирование, однако, является ингибирующим и предотвращает связывание Ndt80 с MSE в присутствии DSB[32].
Роли вне прогрессии клеточного цикла
правитьГетерокарионная несовместимость
правитьГетерокарионную несовместимость (HI) сравнивают с грибковой иммунной системой[33]; это механизм несамораспознавания, который повсеместно распространен среди нитевидных представителей типа Asomycota царства Fungi[34]. Vib-1 является гомологом Ndt80 у Neurospora crassa и необходим для HI у этого вида. Было обнаружено, что мутации в локусе vib1 подавляют чужеродное распознавание, а VIB-1 необходим для продукции нижестоящих эффекторов, связанных с HI, таких как внеклеточные протеазы[35][36].
Женское половое развитие
правитьИсследования показали, что гомологи Ndt80 также играют роль в половом развитии самок у видов грибов, отличных от более широко изучаемых Saccharomyces cerevisiae[35][37]. Было обнаружено, что мутации в vib-1 влияют на сроки и развитие женских репродуктивных структур до оплодотворения[37].
Роль в развитии рака
правитьХотя ДНК-связывающий домен Ndt80 обычно характерен для дрожжей и других грибов, он гомологичен ряду белков высших эукариот, а остатки, используемые для связывания, высококонсервативны. У людей гомолог Ndt80 C11orf9 в высокой степени экспрессируется в инвазивных или метастатических опухолевых клетках, что предполагает потенциальное использование в качестве молекулы-мишени при лечении рака[38]. Однако в последние годы в этом направлении не было достигнуто большого прогресса.
См. также
правитьПримечания
править- ↑ 1 2 Chapter 9: Meitosis // The Cell Cycle: Principles of Control. — London : New Science Press Ltd, 2007. — ISBN 978-0-87893-508-6.
- ↑ "An expanded inventory of conserved meiotic genes provides evidence for sex in Trichomonas vaginalis". PLOS ONE. 3 (8): e2879. August 2007. Bibcode:2008PLoSO...3.2879M. doi:10.1371/journal.pone.0002879. PMID 18663385.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 "Surveillance of different recombination defects in mouse spermatocytes yields distinct responses despite elimination at an identical developmental stage" (PDF). Molecular and Cellular Biology. 25 (16): 7203—15. August 2005. doi:10.1128/MCB.25.16.7203-7215.2005. PMID 16055729. Архивировано (PDF) 20 сентября 2022. Дата обращения: 16 сентября 2022.
{{cite journal}}: Недопустимый|display-authors=6(справка) - ↑ "Meiotic double-strand breaks at the interface of chromosome movement, chromosome remodeling, and reductional division". Genes & Development. 17 (21): 2675—87. November 2003. doi:10.1101/gad.275203. PMID 14563680.
- ↑ "A conserved checkpoint monitors meiotic chromosome synapsis in Caenorhabditis elegans". Science. 310 (5754): 1683—6. December 2005. Bibcode:2005Sci...310.1683B. doi:10.1126/science.1117468. PMID 16339446.
- ↑ "The meiotic checkpoint monitoring synapsis eliminates spermatocytes via p53-independent apoptosis". Nature Genetics. 18 (3): 257—61. March 1998. doi:10.1038/ng0398-257. PMID 9500548.
- ↑ "Meiotic sex chromosome inactivation in male mice with targeted disruptions of Xist". Journal of Cell Science. 115 (Pt 21): 4097—105. November 2002. doi:10.1242/jcs.00111. PMID 12356914.
- ↑ "Distinct DNA-damage-dependent and -independent responses drive the loss of oocytes in recombination-defective mouse mutants". Proceedings of the National Academy of Sciences of the United States of America. 102 (3): 737—42. January 2005. Bibcode:2005PNAS..102..737D. doi:10.1073/pnas.0406212102. PMID 15640358.
- ↑ "A high incidence of meiotic silencing of unsynapsed chromatin is not associated with substantial pachytene loss in heterozygous male mice carrying multiple simple robertsonian translocations". PLOS Genetics. 5 (8): e1000625. August 2009. doi:10.1371/journal.pgen.1000625. PMID 19714216.
{{cite journal}}: Недопустимый|display-authors=6(справка)Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Checkpoint mechanisms: the puppet masters of meiotic prophase". Trends in Cell Biology. 21 (7): 393—400. July 2011. doi:10.1016/j.tcb.2011.03.004. PMID 21531561.
- ↑ "The meiotic checkpoint network: step-by-step through meiotic prophase". Cold Spring Harbor Perspectives in Biology. 6 (10): a016675. October 2014. doi:10.1101/cshperspect.a016675. PMID 25274702.
- ↑ 1 2 3 "Atm-dependent interactions of a mammalian chk1 homolog with meiotic chromosomes". Current Biology. 7 (12): 977—86. December 1997. doi:10.1016/s0960-9822(06)00417-9. PMID 9382850.
{{cite journal}}: Недопустимый|display-authors=6(справка) - ↑ "Checkpoint kinase 1 is essential for meiotic cell cycle regulation in mouse oocytes". Cell Cycle. 11 (10): 1948—55. May 2012. doi:10.4161/cc.20279. PMID 22544319.
{{cite journal}}: Недопустимый|display-authors=6(справка) - ↑ "Chk2 regulates cell cycle progression during mouse oocyte maturation and early embryo development". Molecules and Cells. 37 (2): 126—32. February 2014. doi:10.14348/molcells.2014.2259. PMID 24598997.
- ↑ "Reversal of female infertility by Chk2 ablation reveals the oocyte DNA damage checkpoint pathway". Science. 343 (6170): 533—6. January 2014. Bibcode:2014Sci...343..533B. doi:10.1126/science.1247671. PMID 24482479.
- ↑ "High-dose irradiation induces cell cycle arrest, apoptosis, and developmental defects during Drosophila oogenesis". PLOS ONE. 9 (2): e89009. 2014. Bibcode:2014PLoSO...989009S. doi:10.1371/journal.pone.0089009. PMID 24551207.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ 1 2 "NDT80, a meiosis-specific gene required for exit from pachytene in Saccharomyces cerevisiae". Molecular and Cellular Biology. 15 (12): 6572—81. December 1995. doi:10.1128/MCB.15.12.6572. PMID 8524222.
- ↑ "Gametogenesis in yeast is regulated by a transcriptional cascade dependent on Ndt80". Molecular Cell. 1 (5): 685—96. April 1998. doi:10.1016/S1097-2765(00)80068-4. PMID 9660952.
- ↑ "Regulation of gene expression during meiosis in Saccharomyces cerevisiae: SPR3 is controlled by both ABFI and a new sporulation control element". Molecular and Cellular Biology. 17 (3): 1152—9. March 1997. doi:10.1128/MCB.17.3.1152. PMID 9032242.
- ↑ "Structure of the sporulation-specific transcription factor Ndt80 bound to DNA". The EMBO Journal. 21 (21): 5721—32. November 2002. doi:10.1093/emboj/cdf572. PMID 12411490.
- ↑ "Atomic models for the polypeptide backbones of myohemerythrin and hemerythrin". Biochemical and Biophysical Research Communications. 66 (4): 1349—56. October 1975. doi:10.1016/0006-291x(75)90508-2. PMID 5.
- ↑ J. L. Lubischer. The Cell Cycle, Principles of Control. David O. Morgan. (англ.) // Integrative and Comparative Biology. — 2007-06-01. — Vol. 47, iss. 5. — P. 794–795. — ISSN 1557-7023 1540-7063, 1557-7023. — doi:10.1093/icb/icm066. Архивировано 17 октября 2022 года.
- ↑ "The pachytene checkpoint". Trends in Genetics. 16 (9): 395—403. September 2000. doi:10.1016/s0168-9525(00)02080-1. PMID 10973068.
- ↑ 1 2 "The pachytene checkpoint prevents accumulation and phosphorylation of the meiosis-specific transcription factor Ndt80". Proceedings of the National Academy of Sciences of the United States of America. 97 (22): 12187—92. October 2000. Bibcode:2000PNAS...9712187T. doi:10.1073/pnas.220464597. PMID 11035815.
- ↑ "CDK-dependent nuclear localization of B-cyclin Clb1 promotes FEAR activation during meiosis I in budding yeast". PLOS ONE. 8 (11): e79001. 2013-11-01. Bibcode:2013PLoSO...879001T. doi:10.1371/journal.pone.0079001. PMID 24223874.
{{cite journal}}: Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Meiosis I is established through division-specific translational control of a cyclin". Cell. 133 (2): 280—91. April 2008. doi:10.1016/j.cell.2008.02.032. PMID 18423199.
- ↑ "Phosphorylation and maximal activity of Saccharomyces cerevisiae meiosis-specific transcription factor Ndt80 is dependent on Ime2". Molecular and Cellular Biology. 22 (20): 7024—40. October 2002. doi:10.1128/MCB.22.20.7024-7040.2002. PMID 12242283.
- ↑ "Polo-like kinase Cdc5 promotes chiasmata formation and cosegregation of sister centromeres at meiosis I". Nature Cell Biology. 5 (5): 480—5. May 2003. doi:10.1038/ncb977. PMID 12717442.
- ↑ "Polo-like kinase Cdc5 drives exit from pachytene during budding yeast meiosis". Genes & Development. 22 (19): 2627—32. October 2008. doi:10.1101/gad.1711408. PMID 18832066.
- ↑ "Role of Ndt80, Sum1, and Swe1 as targets of the meiotic recombination checkpoint that control exit from pachytene and spore formation in Saccharomyces cerevisiae". Molecular and Cellular Biology. 22 (18): 6430—40. September 2002. doi:10.1128/MCB.22.18.6430-6440.2002. PMID 12192042.
- ↑ "Self-organization of meiotic recombination initiation: general principles and molecular pathways". Annual Review of Genetics. 48 (1): 187—214. 2014-11-23. doi:10.1146/annurev-genet-120213-092304. PMID 25421598.
- ↑ "Mek1 coordinates meiotic progression with DNA break repair by directly phosphorylating and inhibiting the yeast pachytene exit regulator Ndt80". PLOS Genetics. 14 (11): e1007832. November 2018. doi:10.1371/journal.pgen.1007832. PMID 30496175.
{{cite journal}}: Недопустимый|display-authors=6(справка)Википедия:Обслуживание CS1 (не помеченный открытым DOI) (ссылка) - ↑ "Fungal incompatibility: evolutionary origin in pathogen defense?". BioEssays. 31 (11): 1201—10. November 2009. doi:10.1002/bies.200900085. PMID 19795412.
- ↑ "Molecular genetics of heterokaryon incompatibility in filamentous ascomycetes". Microbiology and Molecular Biology Reviews. 64 (3): 489—502. September 2000. doi:10.1128/MMBR.64.3.489-502.2000. PMID 10974123.
- ↑ 1 2 "Meiotic regulators Ndt80 and ime2 have different roles in Saccharomyces and Neurospora". Genetics. 185 (4): 1271—82. August 2010. doi:10.1534/genetics.110.117184. PMID 20519745.
- ↑ "VIB-1 is required for expression of genes necessary for programmed cell death in Neurospora crassa". Eukaryotic Cell. 5 (12): 2161—73. December 2006. doi:10.1128/EC.00253-06. PMID 17012538.
- ↑ 1 2 "Extreme Diversity in the Regulation of Ndt80-Like Transcription Factors in Fungi". G3. 5 (12): 2783—92. October 2015. doi:10.1534/g3.115.021378. PMID 26497142.
- ↑ "Crystallographic studies of a novel DNA-binding domain from the yeast transcriptional activator Ndt80". Acta Crystallographica. Section D, Biological Crystallography. 58 (Pt 12): 2127—30. December 2002. doi:10.2210/pdb1m6u/pdb. PMID 12454476.