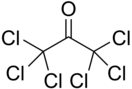
Гексахлорацетон
Гексахлорацетóн — хлорорганическое соединение, производное ацетона, с общей формулой ССl3-CO-CCl3. Относится классу галогенпроизводных кетонов. Как и многие хлорорганические соединения обладает ярко выраженным раздражающим воздействием на кожу и слизистые оболочки (ирритант).
| Гексахлорацетон | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
1,1,1,3,3,3-гексахлорпропанон | ||
| Сокращения | ГХА | ||
| Традиционные названия | Гексахлорацетон, перхлорацетон | ||
| Хим. формула | С3Сl6O | ||
| Рац. формула | ССl3-CO-CCl3 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость с неприятным запахом | ||
| Молярная масса | 264,7477 г/моль | ||
| Плотность | 1,744 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -2 °C | ||
| • кипения | 202-204 °C | ||
| Давление пара | 40 мм.рт.ст. (110 °С) | ||
| Оптические свойства | |||
| Показатель преломления | 1,7439 | ||
| Классификация | |||
| Рег. номер CAS | 116-16-5 | ||
| PubChem | 8303 | ||
| Рег. номер EINECS | 204-129-5 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 82243 | ||
| Номер ООН | 2661 | ||
| ChemSpider | 13873693 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м3 | ||
| ЛД50 | 1200 мг/кг (мыши, перорально)[1]. | ||
| Токсичность | умеренно токсичен, ирритант | ||
| Пиктограммы ECB |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
правитьГексахлорацетон получают исчерпывающим жидкофазным хлорированием изопропилового спирта или ацетона до пентахлорацетона с последующим его каталитическим хлорированием до образования гексахлорпроизводного[2]:
Наиболее высокий выход гексахлорацетона (85%) получается жидкофазным хлорированием трихлорацетона под действием катализатора (активированного угля)[1]:
Физические свойства
правитьПредставляет собой тяжёлую бесцветную жидкость c характерным неприятным запахом, практически не растворимую в воде, но медленно с ней взаимодействует, образуя частично растворимый гидрат C3Cl6O·H2O (т.плав. 15 °С)[1], хорошо растворяется в органических растворителях. Температура плавления -2 °С, чистый гексахлорацетон кипит при 204 °С. Плотность при 12 °С составляет 1,744 г/см3, давление паров 40 мм рт. ст. (5,33 кПа, 110 °С), показатель преломления 1,7439 (25 °С)[2].
Химические свойства
правитьРеакция гидратации.
Гексахлорацетон взаимодействует с водой, образуя мономолекулярный гидрат:
Реакции элиминирования (расщепления).
При взаимодействии гексахлорацетона с водными растворами щелочей при обычной температуре расщепляется с образованием солей трихлорацета и хлороформа:
Со спиртовыми растворами щелочей образует хлороформ и эфиры трихлоруксусной кислоты:
В водных растворах аммиака расщепляется на хлороформ и трихлорацетамид[2]:
Применение
правитьГексахлорацетон применяется в основном для синтеза фторпроизводных ацетона, а также для одновременного получения хлороформа и трихлорацетата. В сельском хозяйстве под маркой ГХА используется в качестве гербицида для борьбы с сорняками однодольных растений (злаков)[2].
Токсикология
правитьЖивотные Для белых мышей при вдыхании паров ЛК50 = 0,92 мг/л. Минимальная смертельная концентрация 0,78 мг/л. При остром отравлении — раздражение глаз и дыхательных путей, возбуждающее и угнетающее действие на центральную нервную систему. У мышей найдены бронхиты, зернистая дистрофия печени, почек, сердечной мышцы. Для белых крыс при экспозиции 3 часа ЛК50 = 7,15 мг/л, а при 6 часов — 3,9 мг/л. На вскрытии — обширные кровоизлияния и ожоги в лёгких. После однократного 2-часового воздействия 1 мг/л гексахлорацетона определяется в крови животных в течение 4—5 суток, а в моче— 12—15 суток. Воздействие на крыс в продолжение 4 месяцев по 4 часа в день концентраций 0,003—0,005 мг/л. вызывало те же изменения, что и пентахлорацетон в аналогичных условиях[3].
Человек Порог раздражающего действия паров 0,001—0,0009 мг/л[3].
Действие на кожу У кроликов при нанесении на кожу — воспалительная реакция с образованием струпа[3].
Предельно допустимая концентрация 0,5 мг/м3[3].
Примечания
править- ↑ 1 2 3 Мельников Н.Н. Пестициды. Химия, технология и применение. — М.: «Химия», 1987. — С. 69-71. — 712 с.
- ↑ 1 2 3 4 Ошин Л.А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с.
- ↑ 1 2 3 4 Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. / Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. мед. наук Э. Н. Левиной. — Изд. 7-е, пер. и доп. — Л.: «Химия», 1976. — Т. I. — С. 340-341. — 592 с. — 49 000 экз.