Дихромовая кислота
Дихромовая (двухромовая, бихромовая) кислота — сильная неорганическая кислота с формулой H2Cr2O7. Образует соли — дихроматы — дихромат калия, дихромат натрия, дихромат аммония и др. Вторая из кислот, в которую входят атомы хрома в высшей степени окисления (+6). Структурная единица H2Cr2O7 является продуктом конденсации (олигомеризации с выделением молекулы H2O) двух структурных единиц хромовой кислоты H2CrO4 в кислой среде. Большинство солей дихромовой кислоты имеют оранжево-красный цвет. Данная кислота смертельно ядовита и канцерогенна как и другие соединения хрома со степенью окисления атомов хрома +6. Самая известная соль дихромовой кислоты — дихромат калия, или хромпик, являющийся сильным окислителем.
| Дихромовая кислота | |
|---|---|
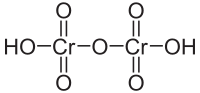 Структурная формула молекулы дихромовой кислоты в неионизованной форме | |
| Общие | |
| Систематическое наименование |
Дихромовая кислота |
| Традиционные названия | Дихромовая кислота |
| Хим. формула | H2Cr2O7 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 218,0010 г/моль |
| Классификация | |
| Рег. номер CAS | 13530-68-2 |
| PubChem | 26090 |
| Рег. номер EINECS | 236-881-5 |
| SMILES | |
| InChI | |
| ChEBI | 23234 |
| ChemSpider | 24302 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение править
Получение дихромовой кислоты происходит, наряду с хромовой, трихромовой и тетрахромовой кислотами, при действии воды на оксид хрома(VI). Для избирательного получения дихромовой кислоты часто используется действие воды на избыток CrO3, однако в растворе так или иначе присутствуют другие полихромовые кислоты.
Помимо гидролиза оксида хрома(VI), дихромовая кислота образуется в процессе окисления солей хрома(III) сильными окислителями, такими как метависмутаты, в сильнокислой среде:
При действии кислоты на хроматы или хромовую кислоту происходит конденсация анионов хромата с образованием анионов дихромата:
Химические свойства править
В сильнокислой среде анионы, содержащие хром(VI), олигомеризуются вплоть до тетрахромата (4 атома хрома(VI) в анионе) и, затем, гидратированного триоксида хрома полимерного строения:
Дихромовая кислота и её анион устойчивы только в подкисленном растворе, при добавлении достаточного количества щёлочи (основания) происходит расщепление аниона дихромата с образованием двух анионов хромата:
При добавлении небольшого количества основания возможно получение дихромата калия из дихромовой кислоты согласно кислотно-основному равновесию:
Аналогично кислоте, соли дихромовой кислоты — дихроматы — в щелочной среде переходят в хроматы, наблюдается пожелтение раствора:
Применение править
Реактив на серебро править
Дихромовая кислота в смеси с серной применяется в качестве реактива на серебро. Данная реакция используется для обнаружения серебра: в присутствии ионов Ag+ выпадает тёмно-красный осадок дихромат серебра.
Токсичность править
Дихромовая кислота ядовита и канцерогенна, как и другие соединения шестивалентного хрома.
В статье не хватает ссылок на источники (см. рекомендации по поиску). |