Вирус иммунодефицита обезьян
Вирус иммунодефицита обезьян (англ. Simian immunodeficiency virus, сокращённо ВИО, англ. SIV) — ретровирус из рода лентивирусов, вызывающий персистирующие инфекции по крайней мере у 45 видов нечеловекообразных приматов[2][3]. На основании анализа штаммов, обнаруженных у четырёх видов обезьян с острова Биоко, который был изолирован от материка в результате повышения уровня моря около 11 000 лет назад, был сделан вывод, что ВИО присутствовал у обезьян в течение по крайней мере 32 000 лет, а возможно, и намного дольше[4][5].
| Вирус иммунодефицита обезьян | ||||||||
|---|---|---|---|---|---|---|---|---|
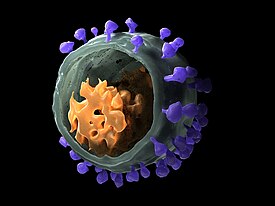 Модель вириона ВИО, полученная с помощью криоэлектронной микроскопии | ||||||||
| Научная классификация | ||||||||
|
Реалм: Царство: Pararnavirae Тип: Artverviricota Класс: Порядок: Семейство: Подсемейство: Род: Группа: Primate lentivirus group |
||||||||
| Международное научное название | ||||||||
| Primate lentivirus group | ||||||||
| Группа по Балтимору | ||||||||
| VI: оцРНК-ОТ-вирусы | ||||||||
| ||||||||
Иммунодефицит, напоминающий человеческий СПИД, регистрировался у содержащихся в неволе обезьян в США, начиная с 1983 года[6][7][8]. ВИО был определён несколькими различными лабораторными методами, в том числе методом иммуно-ПЭТ (выявление антител к вирусу посредством позитронно-эмиссионной томографии)[9].
В настоящее время ВИО зарегистрирован у 26 различных видов африканских приматов[10]. Этот вирус может быть передан половым путём через слизистую оболочку (многослойный плоский эпителий) крайней плоти и головки полового члена, изначально инфицирует клетки Ларгенганса в матке, шейке матки и влагалище животных (на примере макак резус), а затем последующие раунды репликации происходят в дренирующих лимфатических узлах до распространения в кровоток и отдалённую лимфоидную ткань[11]. Несмотря на антиретровирусную терапию, в организме животных формируются резервуары латентных или мутировавших ВИО, например, в семени[12], в головном мозге животных[13], в селезенке, лимфоузлах и тимусе.
Считается, что вирусные штаммы трёх видов приматов, SIVsmm у дымчатых мангабеев, SIVgor у горилл и SIVcpz у шимпанзе, пересекли межвидовой барьер и попали в организм человека, что привело к образованию двух вирусов иммунодефицита человека: ВИЧ-1 и ВИЧ-2 соответственно. Наиболее вероятным путем передачи ВИЧ-1 человеку является контакт с кровью шимпанзе и горилл, на которых в Африке часто охотятся ради мяса. Четыре группы ВИЧ-1 (M, N, O и P) образовались в результате независимых случаев передачи ВИО от обезьяны к человеку, и последующей мутации вируса до ВИЧ[14].
Проведение исследований с вирусом иммунодефицита обезьян и вызываемого им заболевания у обезьян обусловлено сходством этого вируса с ВИЧ и симптомами СПИДа у человека[15]. Животные обычно индуцируют клеточный и гуморальный иммунные ответы, которые частично контролируют, но не элиминируют вирус. Гибель наступает через 1-2 года в результате снижения иммунного статуса макроорганизма[16]. В ряде случаев ВИО оказывается непатогенным из-за эволюционной адаптации носителя к вирусу. Обширные исследования на дымчатых мангабеях установили, что инфекция ВИО не вызывает никаких заболеваний у этих приматов, несмотря на высокие концентрации вируса в их организме. Модуляция активности корецептора CCR5 является одной из естественных способов предотвращения заболевания у некоторых носителей ВИО[17].
Примечания править
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Peeters M, Courgnaud V, Abela B (2001). "Genetic Diversity of Lentiviruses in Non-Human Primates" (PDF). AIDS Reviews. 3: 3—10. Архивировано (PDF) из оригинала 14 июля 2020. Дата обращения: 11 июля 2020.
- ↑ Overview of Primate Lentiviruses and their Evolution in Non-human Primates in Africa. — Theoretical Biology and Biophysics Group, Los Alamos National Laboratory, 2002. — P. 2–23. Архивная копия от 1 декабря 2019 на Wayback Machine
- ↑ McNeil Jr DG (2010-09-16). "Precursor to H.I.V. Was in Monkeys for Millennia". New York Times. Архивировано из оригинала 11 декабря 2019. Дата обращения: 17 сентября 2010.
- ↑ Worobey M, Telfer P, Souquière S, Hunter M, Coleman CA, Metzger MJ, et al. (September 2010). "Island biogeography reveals the deep history of SIV". Science. 329 (5998): 1487. Bibcode:2010Sci...329.1487W. doi:10.1126/science.1193550. PMID 20847261. S2CID 37803712.
- ↑ Letvin NL, Eaton KA, Aldrich WR, Sehgal PK, Blake BJ, Schlossman SF, et al. (May 1983). "Acquired immunodeficiency syndrome in a colony of macaque monkeys". Proceedings of the National Academy of Sciences of the United States of America. 80 (9): 2718—2722. Bibcode:1983PNAS...80.2718L. doi:10.1073/pnas.80.9.2718. PMC 393899. PMID 6221343.
- ↑ Daniel MD, Letvin NL, King NW, Kannagi M, Sehgal PK, Hunt RD, et al. (June 1985). "Isolation of T-cell tropic HTLV-III-like retrovirus from macaques". Science. 228 (4704): 1201—1204. Bibcode:1985Sci...228.1201D. doi:10.1126/science.3159089. PMID 3159089.
- ↑ King NW, Hunt RD, Letvin NL (December 1983). "Histopathologic changes in macaques with an acquired immunodeficiency syndrome (AIDS)". The American Journal of Pathology. 113 (3): 382—388. PMC 1916356. PMID 6316791.
- ↑ Roussel M., Pontier D., Kazanji M., Ngoubangoye B., Mahieux R., Verrier D., Fouchet D. Quantifying transmission by stage of infection in the field: the example of SIV-1 and STLV-1 infecting mandril // American Journal of Primatology. — 2005. — Vol. 77, № 3. — С. 309–318.
- ↑ Улюкин И.М., Щербак Н.Я., Антипина И.А., Андреева Н.В., Орлова Е.С. Ретровирусы обезьян как вероятная опасность для человеческой популяции // ВИЧ-инфекция и иммуносупрессии. — 2016. — № 8 (1). — С. 19—30. — doi:10.22328/2077-9828-2016-8-1-19-30.
- ↑ Salle B., Brochard P., Bourry O., Mannioui A., Andrieu T., Prevot S., Dejucq-Rainsford N., Dereuddre-Bosquet N., Le Grand R. nfection of maca- ques after vaginal exposure to cell-associated simian immunodeficiency virus // International Journal of Infectious Diseases. — 2010. — Vol. 202, № 3. — С. 337–344.
- ↑ Matusali G., Dereuddre-Bosquet N., Le Tortorec A., Moreau M., Satie A.P., Mahé D., Roumaud P., Bourry O., Sylla N., Bernard-Stoecklin S., Pruvost A., Le Grand R., Dejucq-Rainsford N. Detection of Simian Immunodeficiency Virus in Semen, Urethra, and Male Reproductive Organs during Efficient Highly Active Antiretroviral Therapy // Virology Journal. — 2015. — Vol. 89, № 11. — С. 5772–5787.
- ↑ Clements J.E., Gama L., Graham D.R., Mankowski J.L., Zink M.C. A simian immunodeficiency virus macaque model of highly active antiretro- viral treatment: viral latency in the periphery and the central nervous system // Curr. Opin. HIV AID. — 2011. — Vol. 6, № 1. — С. 37–42.
- ↑ Sharp P. M., Hahn B. H. Origins of HIV and the AIDS pandemic. (англ.) // Cold Spring Harbor perspectives in medicine. — 2011. — Vol. 1, no. 1. — P. 006841. — doi:10.1101/cshperspect.a006841. — PMID 22229120.
- ↑ Л.Ф. Стовба, В.Т. Кротков, Д.И. Павельев, С.А. Мельников, В.Н. Лебедев, С.В. Борисевич. Анализ и перспективы применения рекомбинантного вируса вакцины, штамм MVA, в качестве вектора при разработке вакцин против заболеваний, вызванных вирусами иммунодефицита человека и обезьян // Проблемы особо опасных инфекций. — 2019. — № 2. — С. 37—44. — doi:10.21055/0370-1069-2019-2-37-44.
- ↑ Ourmanov I., Kuwata T., Goeken R., Goldstein S., Iyengar R., Buckler-White A., Lafont B., Hirsch V.M. Improved survival in rhesus macaques immunized with modified vaccinia virus Ankara recombinants expressing simian immunodeficiency virus envelope correlates with reduction in memory CD4+ T-cell loss and higher ti- ters of neutralizing antibody // Journal of Virology. — 2009. — № 83 (11). — С. 388–400. — doi:10.1128/JVI.02598-08.
- ↑ Jasinska AJ, Pandrea I, Apetrei C (2022-01-27). "CCR5 as a Coreceptor for Human Immunodeficiency Virus and Simian Immunodeficiency Viruses: A Prototypic Love-Hate Affair". Frontiers in Immunology. 13: 835994. doi:10.3389/fimmu.2022.835994. ISSN 1664-3224. PMC 8829453. PMID 35154162.