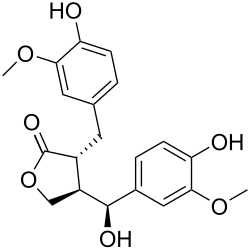
7-Гидроксиматаирезинол
7-Гидроксиматаирезинол (7-ГМР) — лигнан, найденный в экстрактах ели обыкновенной (Picea abies), пихты белой (Abies alba), дугласовой пихты (Pseudotsuga menziesii) и других хвойных деревьев. 7-ГМР также является основным лигнаном зерновых (пшеницы, овса, ячменя, проса), отрубей кукурузы и цельного зерна амаранта[1]. В норвежских хвойных деревьях содержание гидроксиматерезинола достигает 84 % от общего количества лигнанов[2]. 7-ГМР и другие растительные лигнаны (матаирезинол, диглюкозид секоизоларициресинола, секоизоларициресинол, ларициресинол, изоларицирезинол, сирингарезинол, медиресинол, пинорезинол, сезаминол, сезамолинол) проявляют антиоксидантные[3], противовоспалительные, противомикробные и противоопухолевые свойства[4][5].
| 7-гидроксиматаирезинол | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
(3R,4R)-4-[(S)-гидрокси(4-гидрокси-3-метоксифенил)метил]-3-(4-гидрокси-3-метоксибензил)дигидро-2(3H)-фуранон |
| Сокращения | 7-HMR, 7-ГМР |
| Традиционные названия | 7-гидроксиматаирезинол, (−)-гидроксиматаирезинол, гидроксиматаиресинол, 7-гидроксиматаиресинол |
| Хим. формула | C20H22O7 |
| Физические свойства | |
| Состояние | кристаллический порошок |
| Молярная масса | 374,389 г/моль |
| Термические свойства | |
| Температура | |
| • разложения | 100-120 °C |
| Химические свойства | |
| Растворимость | |
| • в этаноле | трудно растворим |
| • в воде | нерастворим |
| Классификация | |
| Рег. номер CAS | 20268-71-7 |
| PubChem | 10948757 |
| SMILES | |
| InChI | |
| ChemSpider | 9123982 |
| Безопасность | |
| Токсичность | низкотоксичен (прием 1 г полностью безопасен) |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фармакокинетика 7-ГМР править
Фармакокинетика, биодоступность и влияние 7-гидроксиматерезинона на клинические симптомы в постменопаузе были исследованы у женщин, не получавших заместительную гормонотерапию (n=22). Участницы получали 36 мг/сут 7-ГМР, либо 72 мг/сут 7-ГМР в течение 8 недель. Фармакокинетический анализ показал Cmax=757 нг/мл при tmax=1 ч. К 8-й недели исследования уровни плазмы 7-ГМР достоверно увеличились при использовании обеих доз 7-ГМР (p<0.05). Показано, что под воздействием кишечной флоры 7-гидроксиматаирезинол трансформируется в энтеролактон — основной продукт биотрансформации растительных лигнанов в организме, способствующий снижению частоты приливов[6].
Токсичность 7-ГМР править
В исследованиях хронической токсичности 7-ГМР был практически нетоксичным при назначении крысам (2000 мг/кг/сут, 28 сут) и собакам (665 мг/кг/сут, 28 сут), несмотря на то, что 7-ГМР хорошо всасывается (>50 % дозы) и быстро элиминируется[7]. 7-ГМР в дозах 140—180 мг/кг/сут, 460—740 мг/кг/сут и 1190—2930 мг/кг/сут не влияет на репродуктивную функцию и не вызывает тератогенеза у беременных крыс. Масса тела и потребление пищи уменьшались во всех группах лечения в течение первых трех дней периода беременности вследствие снижения вкусовой привлекательности корма, так как в 7-ГМР имеет характерный горьковатый вкус[8]. В исследовании с участием здоровых добровольцев-мужчин 7-ГМР давался однократно, в дозах до 1350 мг. В результате проведение исследования не было установлено каких-либо побочных эффектов от приёма 7-ГМР[7].
Фармацевтические субстанции 7-ГМР, содержание в различных препаратах править
Субстанции различной степени очистки выпускаются рядом производителей: R&D Chemicals (субстанция «Arbo 2»), Chemieliva Pharmaceutical Co. (субстанция «PBCM123022»), ZINC (субстанция «ZINC40896750»), CheMall Corporation (субстанция «HE065349») и др. Выпускается субстанция «HMRLignan» фармакологического качества (Linnea). Известны БАД «HMR Lignans» (дозировка 10 мг), «Flaxseed Lignans Organic» (15 мг) и др. Поиск по базе данных RLSNET и по справочнику Видаль показал, что в РФ представлен БАД «Лигнариус» (ООО Космофарм), содержащий 30 мг субстанции 7-ГМР от Provero Pharma v.o.f. (Нидерланды) 7-HMR.
Противовоспалительные свойства 7-ГМР править
7-ГМР проявляет выраженную противовоспалительную активность и является эффективным ингибитором специфических воспалительных реакций с участием клеток, регулирующих процессы воспаления — моноцитов и гранулоцитов. В моноцитах линии ТНР-1 лигнан 7-ГМР дозозависимо ингибировал синтез/секрецию ФНО-α, а в гранулоцитах — снижал уровни активных форм кислорода и провоспалительного интерлейкина IL-8[9]. В эндотелиальных клетках аорты 7-ГМР ингибирует ФНО-α-индуцированную экспрессию белков клеточной адгезии ICAM-1, приводит к более низкой активации провоспалительного фактора транскрипции NF-kB (на 30…80 %)[10]. В результате блокировки активности NF-κB 7-ГМР подавлял экспрессию мРНК и белка провоспалительных медиаторов ФНО-α (молекулы адгезии сосудистых клеток-1, интерлейкина-6, индуцибельной синтазы оксида азота)[11].
Потенциальные (анти)эстрогенные свойства 7-ГМР править
Опубликованных исследований, в которых было бы продемонстрировано непосредственное связывание 7-ГМР и рецепторов эстрогенов не было найдено. По причине отсутствия прямых данных о взаимодействии 7-ГМР и других растительных лигнанов с рецепторами эстрогенов, имеющиеся косвенные результаты достаточно противоречивы и весьма зависят от использованной методологии исследования. Например, при использовании первичных гепатоцитов линий клеток RTH-149 и ZF-L эстрогеновая активность 7-ГМР (определяемая как дозозависимая секреция белка вителлогенина) не была подтверждена[12]. При исследовании клеточной линии MCF-7, чувствительной к эстрогенам, 7-ГМР увеличивал процент клеток в S-фазе клеточного цикла[13]. При анализе взаимодействий 7-ГМР со стероидными рецепторами in vitro в концентрациях менее 1,0 мкМ для 7-ГМР не было установлено никакой антиандрогенной, эстрогенной или антиэстрогенной активности[14] и т. д.
Противоопухолевые свойства 7-ГМР править
В эксперименте приём 30 мг/кг/сут 7-ГМР имел статистически значимое ингибирующее воздействие на рост опухоли молочной железы крыс, индуцированной диметилбензатраценом (ДМБА)[15]. Противоопухолевый эффект 7-ГМР наблюдался уже при использовании достаточно низкой дозы в 4,7 мг/кг/сут[16]. 7-ГМР и его метаболит энтеролактон уменьшают рост и метастазы клеток опухоли печени, привитых подкожно крысам (клеток гепатомы линии AH109A). Значение показателя IC50 (50 % ингибирующая концентрация) для пролиферации клеток гепатомы составило 200 мкМ, а значение IC50 для инвазии клеток гепатомы — 144 мкМ. 7-ГМР и энтеролактон подавляли пролиферацию клеток гепатомы, удлиняя время деления клеток гепатомы и увеличивая скорость апоптоза[17]. 7-ГМР уменьшал образование полипов и предотвращал накопление бета-катенина в ядре (патофизиологическая метка образования полипов)[7].
7-ГМР дозозависимо тормозит рост солидной карциномы Эрлиха даже на фоне приёма эстрадиола. Противоопухолевый эффект 7-ГМР (Лигнариус) был наиболее выражен при использовании 120 мг/сут 7-ГМР: на 21-е сутки средний объём снижался на 620 мм3, что было достоверно ниже, чем в группе контроля (D=0.59, P=0.00036). Приём 120 мг/сут 7-ГМР достоверно тормозил интенсивность роста опухолевых узлов на фоне приёма эстрогенов: средний объём опухолевого узла на 21-е сутки снижался на 322 мм3 (P=0.007).[18]
Примечания править
- ↑ Smeds A. I., Eklund P. C., Sjöholm R. E., Willför S. M., Nishibe S., Deyama T., Holmbom B. R. Quantification of a broad spectrum of lignans in cereals, oilseeds, and nuts. (англ.) // Journal Of Agricultural And Food Chemistry. — 2007. — 21 February (vol. 55, no. 4). — P. 1337—1346. — doi:10.1021/jf0629134. — PMID 17261017.
- ↑ Hovelstad H., Leirset I., Oyaas K., Fiksdahl A. Screening analyses of pinosylvin stilbenes, resin acids and lignans in Norwegian conifers. (англ.) // Molecules (Basel, Switzerland). — 2006. — 31 January (vol. 11, no. 1). — P. 103—114. — PMID 17962750.
- ↑ Yamauchi S., Sugahara T., Nakashima Y., Okada A., Akiyama K., Kishida T., Maruyama M., Masuda T. Radical and superoxide scavenging activities of matairesinol and oxidized matairesinol. (англ.) // Bioscience, Biotechnology, And Biochemistry. — 2006. — August (vol. 70, no. 8). — P. 1934—1940. — PMID 16926506.
- ↑ Smeds A. I., Eklund P. C., Willför S. M. Chemical characterization of high-molar-mass fractions in a Norway spruce knotwood ethanol extract. (англ.) // Phytochemistry. — 2016. — October (vol. 130). — P. 207—217. — doi:10.1016/j.phytochem.2016.05.006. — PMID 27256310.
- ↑ Gerstenmeyer E., Reimer S., Berghofer E., Schwartz H., Sontag G. Effect of thermal heating on some lignans in flax seeds, sesame seeds and rye. (англ.) // Food Chemistry. — 2013. — 1 June (vol. 138, no. 2-3). — P. 1847—1855. — doi:10.1016/j.foodchem.2012.11.117. — PMID 23411317.
- ↑ Udani J. K., Brown D. J., Tan M. O., Hardy M. Pharmacokinetics and bioavailability of plant lignan 7-hydroxymatairesinol and effects on serum enterolactone and clinical symptoms in postmenopausal women: a single-blinded, parallel, dose-comparison study. (англ.) // Journal Of The American College Of Nutrition. — 2013. — Vol. 32, no. 6. — P. 428—435. — doi:10.1080/07315724.2013.849578. — PMID 24606716.
- ↑ 1 2 3 Kangas L., Saarinen N., Mutanen M., Ahotupa M., Hirsinummi R., Unkila M., Perälä M., Soininen P., Laatikainen R., Korte H., Santti R. Antioxidant and antitumor effects of hydroxymatairesinol (HM-3000, HMR), a lignan isolated from the knots of spruce. (англ.) // European Journal Of Cancer Prevention : The Official Journal Of The European Cancer Prevention Organisation (ECP). — 2002. — August (vol. 11 Suppl 2). — P. 48—57. — PMID 12570335.
- ↑ Wolterbeek A. P., Roberts A., Korte H., Unkila M., Waalkens-Berendsen D. H. Prenatal developmental toxicity study with 7-hydroxymatairesinol potassium acetate (HMRlignan) in rats. (англ.) // Regulatory Toxicology And Pharmacology : RTP. — 2004. — August (vol. 40, no. 1). — P. 1—8. — doi:10.1016/j.yrtph.2004.04.001. — PMID 15265601.
- ↑ Cosentino M., Marino F., Maio R. C., Delle Canne M. G., Luzzani M., Paracchini S., Lecchini S. Immunomodulatory activity of the lignan 7-hydroxymatairesinol potassium acetate (HMR/lignan) extracted from the heartwood of Norway spruce (Picea abies). (англ.) // International Immunopharmacology. — 2010. — March (vol. 10, no. 3). — P. 339—343. — doi:10.1016/j.intimp.2009.12.005. — PMID 20005303.
- ↑ Spilioti E., Holmbom B., Papavassiliou A. G., Moutsatsou P. Lignans 7-hydroxymatairesinol and 7-hydroxymatairesinol 2 exhibit anti-inflammatory activity in human aortic endothelial cells. (англ.) // Molecular Nutrition & Food Research. — 2014. — April (vol. 58, no. 4). — P. 749—759. — doi:10.1002/mnfr.201300318. — PMID 24311533.
- ↑ Yang D., Xiao C. X., Su Z. H., Huang M. W., Qin M., Wu W. J., Jia W. W., Zhu Y. Z., Hu J. F., Liu X. H. (-)-7(S)-hydroxymatairesinol protects against tumor necrosis factor-α-mediated inflammation response in endothelial cells by blocking the MAPK/NF-κB and activating Nrf2/HO-1. (англ.) // Phytomedicine : International Journal Of Phytotherapy And Phytopharmacology. — 2017. — 15 August (vol. 32). — P. 15—23. — doi:10.1016/j.phymed.2017.04.005. — PMID 28732803.
- ↑ Christianson-Heiska I., Isomaa B. The use of primary hepatocytes from brown trout (Salmo trutta lacustris) and the fish cell lines RTH-149 and ZF-L for in vitro screening of (anti)estrogenic activity of wood extractives. (англ.) // Toxicology In Vitro : An International Journal Published In Association With BIBRA. — 2008. — April (vol. 22, no. 3). — P. 589—597. — doi:10.1016/j.tiv.2007.11.016. — PMID 18206344.
- ↑ Cosentino M., Marino F., Ferrari M., Rasini E., Bombelli R., Luini A., Legnaro M., Delle Canne M. G., Luzzani M., Crema F., Paracchini S., Lecchini S. Estrogenic activity of 7-hydroxymatairesinol potassium acetate (HMR/lignan) from Norway spruce (Picea abies) knots and of its active metabolite enterolactone in MCF-7 cells. (англ.) // Pharmacological Research. — 2007. — August (vol. 56, no. 2). — P. 140—147. — doi:10.1016/j.phrs.2007.05.001. — PMID 17572100.
- ↑ Saarinen N. M., Wärri A., Mäkelä S. I., Eckerman C., Reunanen M., Ahotupa M., Salmi S. M., Franke A. A., Kangas L., Santti R. Hydroxymatairesinol, a novel enterolactone precursor with antitumor properties from coniferous tree (Picea abies). (англ.) // Nutrition And Cancer. — 2000. — Vol. 36, no. 2. — P. 207—216. — doi:10.1207/S15327914NC3602_10. — PMID 10890032.
- ↑ Saarinen N. M., Penttinen P. E., Smeds A. I., Hurmerinta T. T., Mäkelä S. I. Structural determinants of plant lignans for growth of mammary tumors and hormonal responses in vivo. (англ.) // The Journal Of Steroid Biochemistry And Molecular Biology. — 2005. — February (vol. 93, no. 2-5). — P. 209—219. — doi:10.1016/j.jsbmb.2004.12.004. — PMID 15860264.
- ↑ Saarinen N. M., Huovinen R., Wärri A., Mäkelä S. I., Valentín-Blasini L., Needham L., Eckerman C., Collan Y. U., Santti R. Uptake and metabolism of hydroxymatairesinol in relation to its anticarcinogenicity in DMBA-induced rat mammary carcinoma model. (англ.) // Nutrition And Cancer. — 2001. — Vol. 41, no. 1-2. — P. 82—90. — doi:10.1080/01635581.2001.9680616. — PMID 12094633.
- ↑ Miura D., Saarinen N. M., Miura Y., Santti R., Yagasaki K. Hydroxymatairesinol and its mammalian metabolite enterolactone reduce the growth and metastasis of subcutaneous AH109A hepatomas in rats. (англ.) // Nutrition And Cancer. — 2007. — Vol. 58, no. 1. — P. 49—59. — doi:10.1080/01635580701308133. — PMID 17571967.
- ↑ Громова О. А., Рубашкина А. Н., Филимонова М. В., Торшин И. Ю., Тетруашвили Н. К., Лапочкина М. П. | Адъювантная терапия 7-ГМР как метод повышения онкологической безопасности приёма эстрогенов Архивная копия от 29 марта 2018 на Wayback Machine. Эффективная фармакотерапия, Акушерство и гинекология, 2018, № 1, с. 20—25.