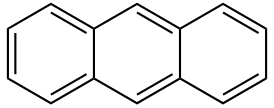
Антрацен
Антраце́н (трицикло-[8.4.0.03,8]-тетрадека-1,3,5,7,9,11,13-гептаен) — углеводород, бесцветные кристаллы, tпл 218° C. Нерастворим в воде, растворим в ацетонитриле и ацетоне, при нагревании растворим в бензоле.
| Антрацен | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
Антрацен |
| Хим. формула | С14Н10 |
| Физические свойства | |
| Молярная масса | 178.23 г/моль |
| Плотность | 1.25 г/см³ |
| Энергия ионизации | 7,45 эВ[1] |
| Термические свойства | |
| Температура | |
| • плавления | 218 °C |
| • кипения | 340 °C |
| Химические свойства | |
| Растворимость | |
| • в спирте | 0.0908 г/100 мл |
| • в гексане | 0.164 г/100 мл |
| Структура | |
| Дипольный момент | 0 Кл·м[1] |
| Классификация | |
| Рег. номер CAS | 120-12-7 |
| PubChem | 8418 |
| Рег. номер EINECS | 204-371-1 |
| SMILES | |
| InChI | |
| ChEBI | 35298 |
| Номер ООН | <-- номер UN --> |
| ChemSpider | 8111 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Химические свойства
правитьПо химическим свойствам сходен с нафталином (легко нитруется, сульфируется и т. д.), но отличается от него тем, что легче вступает в реакции присоединения и окисления.
Антрацен может фотодимеризоваться под действием УФ излучения. Это приводит к существенному изменению свойств вещества.
В димере имеются две ковалентные связи, образованные в результате [2+2] циклоприсоединения. Димер распадается обратно на две молекулы антрацена при нагревании или при УФ облучении с длиной волны ниже 300 нм. Обратимая димеризация и фотохромизм — основание для потенциального использования моно- и полизамещённых антраценов. Реакция чувствительна к кислороду.
В большинстве других реакций антрацена также атакуется центральное ядро, как наиболее активное.
Электрофильное замещение идёт в положения «9» и «10» центрального кольца, антрацен легко окисляется, давая антрахинон, C14H8O2 (ниже).
Получение
правитьАнтрацен получают из каменноугольной смолы. Классическим методом лабораторного получения антрацена является циклодегидратирование о-метил или о-метилензамещённых диарилкетонов в так называемой реакции Эльбса.
Применение
правитьАнтрацен — сырьё для получения антрахинона, многочисленных красителей, например ализарина. В виде кристаллов применяется как сцинтиллятор.
Исследования
правитьВ 2005 химики из Калифорнийского университета в Риверсайде обнаружили первую «двуногую» молекулу 9,10-Дитиоантрацена, которая способна сама двигаться вперёд на плоской медной поверхности при нагревании. Исследователи высказали предположение, что молекула может использоваться в молекулярных компьютерах[2].
В 2010 году антрацен был обнаружен в межзвёздной среде[3].
Примечания
править- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ Ki-Young Kwon, Kin L. Wong, Greg Pawin, Ludwig Bartels, Sergey Stolbov, Talat S. Rahman. Unidirectional Adsorbate Motion on a High-Symmetry Surface: “Walking” Molecules Can Stay the Course (англ.) // The American Physical Society. Physical Review Letters : journal. — 2005. — 11 October (no. PRL 95, 166101). — doi:10.1103/PhysRevLett.95.166101. — PMID 16241817. Архивировано 20 июля 2011 года.
- ↑ Антраценовый космос: Органика в пространстве. «Популярная механика» (23 июня 2010). Дата обращения: 6 ноября 2019. Архивировано 6 ноября 2019 года.
Литература
править- Антрацен // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Антраценовое масло // Большая Советская энциклопедия (в 30 т.) / Гл. ред.: А. М. Прохоров. — 3-е изд. — М.: «Советская Энциклопедия», 1970. — Т. II. — С. 98. — 632 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
