Эта статья нарушает правило о недопустимости инструкций в энциклопедических статьях. |
В статье не хватает ссылок на источники (см. рекомендации по поиску). |
Валсарта́н — антигипертензивное средство, блокатор рецепторов ангиотензина ІІ (БРА). В 2008, 2009 и 2010 годах — самое назначаемое лекарственное средство для лечения артериальной гипертензии в мире. Самый исследованный препарат данного класса — доказательная база включает около 140 тысяч пациентов в различных клинических испытаниях.
| Валсартан | |
|---|---|
| Valsartanum | |
 | |
 | |
| Химическое соединение | |
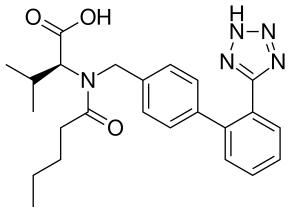
| ИЮПАК | (S)-N-(1-карбокси-2-метилпроп-1-ил)-N-пентаноил-N-[2-(1Н-тетразол-5-ил)бифенил-4-ил-метил]амин |
| Брутто-формула | C24H29N5O3 |
| Молярная масса | 435,5175 г/моль [1] |
| CAS | 137862-53-4 |
| PubChem | 60846 |
| DrugBank | APRD00133 |
| Состав | |
| Классификация | |
| АТХ | C09CA03 |
| Фармакокинетика | |
| Биодоступн. | 25% |
| Связывание с белками плазмы | 95% |
| Метаболизм | Печень (8—10%) |
| Период полувывед. | 6 часов |
| Экскреция | Почки — 30%, Желчь — 70% |
| Лекарственные формы | |
| Таблетки | |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Вазар, Валз, Ванатекс, Вальсакор, Диован, Диокор, Диокор Соло, Квазар | |
Фармакологические свойства
правитьАктивным гормоном ренин-ангиотензин-альдостероновой системы является ангиотензин ІІ, который образуется из ангиотензина І вследствие действия ангиотензин-превращающего фермента. Кроме того, этот процесс может проходить под действием химаз, катепсина и др. ферментов, как произвольно, так и вследствие блокады АПФ. Ангиготензин ІІ связывается со специфическими рецепторами, размещенными на клеточных мембранах многих тканей. Описано от 4 до 7 подтипов рецепторов к ангиотензину ІІ. Взаимодействие ангиотензина ІІ с рецепторами проявляется широким спектром физиологических эффектов, которые включают как прямое, так и косвенное влияние на регуляцию артериального давления. Как вазоконстриктор, ангиотензин ІІ оказывает прямой прессорный эффект при взаимодействии с рецепторами подтипа AT1. Кроме того, при взаимодействии с рецепторами 1-го типа происходит стимулирование фибробластов, последующая дифференцировка их в фиброциты и, как следствие, разрастание соединительной ткани. Также ангиотензин ІІ снижает выведение натрия из организма и стимулирует секрецию альдостерона. При взаимодействии ангиотензина ІІ с рецепторами 2-го типа (AT2) происходит вазодилятационный (сосудорасширяющий) эффект и тормозится пролиферация фибробластов и последующее перерождение в фиброциты в сосудистой стенке, сердечной мышце, ткани почек, поджелудочной железе, головном мозге и других органах и тканях.
Валсартан является пероральным активным специфическим антагонистом (блокатором) рецепторов ангиотензина ІІ (БРА). Выборочно влияет на рецепторы подтипа AT1, которые отвечают за прессорное действие ангиотензина ІІ. Сродство валсартана к AT1-рецепторам в 20 000 — 30 000 раз выше, чем к AT2-рецепторам. Благодаря этому проявляются эффекты двойного механизма снижения артериального давления и антипролиферативные свойства, связанные с взаимодействием ангиотензина ІІ с AT1-рецепторами. Валсартан не влияет на АПФ, который превращает ангиотензин І в ангиотензин ІІ и не влияет на систему брадикинина. Поэтому при применении валсартана возникновение такого побочного эффекта, как кашель, бывает крайне редко, сопоставимо с ноцебо. При повышении дозы и при продолжительном лечении валсартаном количество побочных эффектов, связанных с брадикинином, не увеличивается. Валсартан влияет на сердечно-сосудистую регуляцию, не связывается и не блокирует другие гормональные рецепторы или ионные каналы. Антигипертензивный эффект отмечается в первые 2 ч, а максимальное снижение АД достигается на протяжении 4—6 ч после приёма разовой дозы. Антигипертензивный эффект длится более 24 ч после применения препарата. После 16 недель приёма антигипертензивный эффект может достигать 48 часов, т.е ещё 24 часов после пропущенной дозы. Во время постоянного приёма препарата максимальное снижение АД при применении любой дозы препарата обычно достигается к 2—4 нед и удерживается на протяжении всего периода лечения. Есть прямая взаимосвязь между дозой препарата и временем достижения целевого артериального давления.
Дополнительное снижение АД достигается комбинацией валсартана с гидрохлоротиазидом (препараты Ко-Диован®, Валз, Вальсакор Н, Вальсакор НД, Вазар Н, Диокор и др.), а также с амлодипином и прямым ингибитором ренина алискиреном. Прекращение приема валсартана не сопровождается симптомом «рикошета» или другими побочными клиническими явлениями. Существуют данные о более выраженном снижении артериального давления валсартаном по сравнению с другими БРА. Отмечается, что доза, большая максимально допустимой (выше 320 мг валсартана), не приводит к ортостатически опасному снижению АД.
К современным стратегиям антигипертензивной терапии, которые обеспечивают долговременную комплаентность (приверженность пациента лечению) и антигипертензивную эффективность, необходимую для достижения целевых уровней АД, относится применение фиксированных (в 1 таблетке) комбинаций антигипертензивных препаратов различных классов с установленной эффективностью, хорошей переносимостью и дополнительными преимуществами у определённых категорий пациентов, в частности дигидропиридиновых антагонистов кальция пролонгированного действия (амлодипин) и блокаторов ангиотензиновых рецепторов (валсартан). В результате клинических испытаний установлено, что комбинация амлодипин + валсартан имеет аддитивный антигипертензивный эффект, снижая АД в большей степени, чем каждый из компонентов отдельно. Также показано, что эта комбинация имеет благоприятный профиль переносимости, а дополнительные механизмы действия компонентов минимизируют их характерные побочные эффекты. Так, частота возникновения периферических отёков при применении комбинации амлодипин + валсартан была значимо ниже по сравнению с монотерапией амлодипином, однако, достоверно выше чем при применении комбинаций валсартана с гидрохлортиазидом.
Показания
правитьАртериальная гипертензия, хроническая сердечная недостаточность (в т. ч. после перенесённого инфаркта миокарда; валсартан — единственный сартан, применение которого разрешено в подобных случаях).
Применение
правитьПри АГ средняя терапевтическая доза составляет 160 мг 1 раз в сутки, которую можно повышать до 320 мг 1 раз в сутки. Валсартан также может приниматься сочетанно с другими антигипертензивными агентами. Одновременное применение диуретиков, например, гидрохлоротиазида, снизит АД у пациентов с недостаточным контролем гипертензии.
При хронической сердечной недостаточности начальная доза составляет 40 мг 2 раза в сутки, которую постепенно повышают с интервалами в неделю до 160 мг 2 раза в сутки.
После перенесённого инфаркта миокарда начальная доза составляет 20 мг 2 раза в сутки, которую постепенно повышают с интервалами в неделю до 160 мг 2 раза в сутки.
Есть данные о возможности применения валсартана в дозе 640 мг в сутки. При этом повышение риска возможных побочных реакций не наблюдается, равно как и увеличение терапевтического эффекта. При дополнении к стандартной терапии после коронарной ангиопластики валсартан доказал снижение частоты рестенозов (повторных сужений стента) и количества повторных вмешательств.
Противопоказания
править- Повышенная чувствительность к компонентам препарата или к любому из вспомогательных веществ;
- Тяжёлые нарушения функции печени;
- Билиарный цирроз и холестаз;
- Тяжёлое нарушение функции почек (клиренс креатинина ≤10 мл/мин);
- Проводимый гемодиализ;
- Период беременности и кормления грудью.
Побочные эффекты
правитьС частотой 1 % и те, которые возникают чаще в отношении валсартана, чем плацебо: ортостатическая гипотензия, инфекции верхних дыхательных путей, фарингит, синусит. В редких случаях отмечают невралгию, конъюнктивит, гипотензию, сердечную недостаточность, кашель, носовые кровотечения, диарею, боль в животе, боль в спине, миалгию, артрит, слабость, астению. Нечасто наблюдают гиперкалиемию, депрессию, бессонницу, синкопе. Очень редко отмечают тромбоцитопению, головную боль, кровотечение, ангионевротический отёк, высыпания, зуд, артралгию, нарушение функции почек, острую почечную недостаточность, гастроэнтерит, ринит, васкулит, рак.
Современные исследования, направленные на изучение влияния данного препарата на сердечно-сосудистую систему и развитие диабета, показали, что пациенты с предрасположенностью к возникновению диабетических и сердечно-сосудистых заболеваний, принимающие Валсартан на протяжении 5 лет и ведущие здоровый образ жизни, смогли снизить вероятность проявления диабета, но сердечно-сосудистых последствий применения препарата избежать не удалось [2]
Особые указания
правитьС осторожностью применять у пациентов с двусторонним стенозом почечной артерии, при одновременном применении калийсберегающих диуретиков и препаратов калия. При клиренсе креатинина 10 мл/мин коррекции дозы не требуется. Возможна симптоматическая гипотензия у пациентов со сниженным уровнем натрия и ОЦК, например при применении диуретиков в высоких дозах. С осторожностью применять у пациентов с циррозом печени, в начале терапии хронической сердечной недостаточности, после недавно перенесенного инфаркта миокарда, в сочетании с ингибиторами АПФ.
Для пациентов с нехолестатическим повреждением печени доза валсартана не должна превышать 80 мг.
Безопасность и эффективность применения валсартана у детей установлена в ряде исследований. Разрешён FDA США для применения в детском возрасте (в России к применению у детей не разрешён). В ряде исследований доказано положительное влияние валсартана на сексуальную функцию.
Взаимодействия
правитьВалсартан является первично активным препаратом и не требует метаболизма в печени для проявления своего лечебного эффекта. Вероятность взаимодействия с прапаратами, метаболизирующимися в печени, практически отсутствует. При одновременном применении калиевых добавок, калийсберегающих диуретиков, солевых добавок, содержащих калий, или других лекарственных препаратов, которые могут повышать уровень калия (гепарин и др.), следует быть осторожными и измерять концентрации калия. Не наблюдалось никаких взаимодействий, которые бы имели клиническую значимость, при использовании препаратов, часто применяемых для лечения пациентов с гипертензией: циметидина, варфарина, фуросемида, дигоксина, атенолола, индометацина, гидрохлоротиазида, амлодипина и глибенкламида. Другие антигипертензивные средства могут повышать антигипертензивный эффект валсартана.
Длительное применение НПВС (нестероидных противовоспалительных средств) может снизить антигипертензивное действие антагонистов ангиотензина ІІ. Вместе назначенные НПВС и антагонисты ангиотензина ІІ оказывают аддитивный эффект на повышение уровня сывороточного калия и могут привести к нарушению функции почек. Этот эффект, как правило, имеет обратимый характер. Редко возможно развитие острой почечной недостаточности, в частности, у больных с нарушенной функцией почек, пациентов с обезвоживанием и у лиц пожилого возраста.
В августе 2018 года на конгрессе Европейского кардиологического общества в Мюнхене группа исследователей представила результаты клинических испытаний комбинации валсартана и сакубитрила. В ходе исследования оценивалась безопасность и переносимость препарата сакубитрил/валсартан у пациентов с сердечной недостаточностью со сниженной фракцией выброса левого желудочка (СНнФВ). В течение 10 недель в группах, где первая получала сакубитрил/валсартан в госпитале перед выпиской, а вторая в короткие сроки после выписки — более 86 % пациентов непрерывно принимали комбинацию препаратов в течение 2 недель, и из них около 50 % пациентов достигла терапевтической дозы в 200 мг 2 раза в день в обеих группах. Испытания указали на высокий профиль безопасности взаимодействия препаратов[3].
Передозировка
правитьНет данных относительно передозировки валсартаном. Основным признаком передозировки может являться артериальная гипотензия с головокружением. Лечение зависит от времени, которое прошло после приёма препарата, и тяжести симптомов; стабилизация гемодинамики является наиболее важной. При возникновении гипотензии пациента следует перевести в горизонтальное положение и как можно раньше обеспечить парентеральное введение солевых растворов. Валсартан не выводится путём диализа вследствие значительного связывания с белками плазмы крови.
Канцероген в валсартане
правитьВ 2018 году Европейское агентство по лекарственным средствам (ЕМА) обнаружила в препаратах на основе валсартана производства «Чжэцзян Хуахай Фармасьютикал Ко. Лтд» (Китай) потенциально канцерогенную примесь N-нитрозодиметиламина (NDMA). В июле 2018 года Росздравнадзор начал проводить мероприятия по изъятию с российского рынка препаратов валсартан, содержащих канцероген[4][5]. В ноябре 2018 года Росздравнадзор изъял из обращения 561 серию препаратов с китайской субстанцией.[6].
В феврале 2019 года глобальный отзыв лекарственных препаратов на основе валсартана из-за выявления потенциально онкогенной примеси затронул компанию Pfizer и её бизнес в Японии. Отзыву подлежат более 763 тыс. таблеток препарата Амвало, произведенных с апреля по июль 2018 г. на заводе индийской компании Mylan[7].
См. также
правитьСакубитрил/Валсартан (LCZ696)
Примечания
править- ↑ International Union of Pure and Applied Chemistry. IUPAC Periodic Table of the Elements. — 2016. Архивировано 2 августа 2017 года.
- ↑ Effect of Valsartan on the Incidence of Diabetes and Cardiovascular Events // New England Journal of Medicine. — 2010-04-22. — Т. 362, вып. 16. — С. 1477–1490. — ISSN 0028-4793. — doi:10.1056/NEJMoa1001121.
- ↑ Novartis announces new data that show Entresto® (sacubitril/valsartan) can be initiated early & safely in hospitalized patients after an acute heart failure episode Архивная копия от 10 сентября 2018 на Wayback Machine Novartis, 25.08.2018
- ↑ Росздравнадзор проводит мероприятия по предотвращению возможного вреда от препаратов «Валсартана», произведенных из китайской субстанции ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В СФЕРЕ ЗДРАВООХРАНЕНИЯ
- ↑ EMA reviewing medicines containing valsartan from Zhejiang Huahai following detection of an impurity Архивная копия от 9 ноября 2018 на Wayback Machine European Medicines Agency, 5 July 2018
- ↑ На поступившие запросы СМИ о лекарственных средствах, изготовленных из субстанции «Валсартан», Росздравнадзор сообщает следующее ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В СФЕРЕ ЗДРАВООХРАНЕНИЯ
- ↑ "Pfizer Japan recalls high blood pressure drug over cancer-causing..." Reuters (англ.). 2019-02-09. Архивировано 12 февраля 2019. Дата обращения: 12 февраля 2019.
Ссылки
править- Машковский, М. Д. Валсартан // Лекарственные средства. — 15-е изд. — М. : Новая Волна, 2005. — 1200 с. — ISBN 5-7864-0203-7.
- Валсартан — Информация для врачей и медицинских работников — Справочник Видаль.
- Павел Котляр, Надежда Маркина. Данные клинических результатов одного из самых продаваемых в мире лекарств — валсартана, производимого Novartis, — оказались подтасованы. Газета.ru (21 февраля 2014).
- Markham, Anthony, and Karen L. Goa. "Valsartan." Drugs 54.2 (1997): 299-311.
- NAVIGATOR Study Group. "Effect of valsartan on the incidence of diabetes and cardiovascular events." New England Journal of Medicine 362.16 (2010): 1477-1490.