Сукцинилхолин (Суксаметониум, Диацетилхолин) — лекарственное средство, деполяризующий миорелаксант
| Сукцинилхолин | |
|---|---|
| Succinylcholine | |
 | |
| Химическое соединение | |
| ИЮПАК |
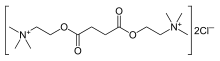
2,2'-[(1,4-диоксибутан-1,4-диил)бис(окси)]бис г(N,N,N-триметилэтанаминий) |
| Брутто-формула | C14H30N2O4²⁺ |
| Молярная масса | 290.399 г/моль |
| CAS | 306-40-1 |
| PubChem | 22475 |
| DrugBank | DB00202 |
| Состав | |
| Классификация | |
| Фармакол. группа | н-Холинолитики (миорелаксанты) |
| АТХ | M03AB01 |
| МКБ-10 | Z100 |
| Фармакокинетика | |
| Метаболизм | Псевдохолинэстеразой до сукцинилмонохолина и холина |
| Экскреция | почками (10 %) |
| Лекарственные формы | |
| Раствор для внутривенного и внутримышечного введения | |
| Способы введения | |
| внутривенно, внутримышечно | |
| Другие названия | |
| Суксаметония хлорид, Суксаметония йодид, Суксаметония бромид, Дитилин, Листенон | |
История
правитьБыл синтезирован Бове (Bovet) в 1949 году и разрешён к применению в клинической практике в 1951 году.
Строение и свойства
правитьПо химическому строению сукцинилхолин — две молекулы ацетилхолина, соединённых между собой (диацетилхолин)[1].
Белый мелкокристаллический порошок. Как и все миорелаксанты, является четвертичным аммониевым соединением. Легко растворим в воде, очень мало — в спирте.
Фармакодинамика
правитьПри внутривенном введении сукцинилхолин связывается с постсинаптическими никотиновыми рецепторами и оказывает ацетилхолин-подобное действие, то есть вызывает деполяризацию мембран[2]. Этот процесс сопровождается мышечными сокращениями, которые клинически проявляются фасцикуляциями (мышечные подёргивания). Этот период характеризуют как I (первая) фаза нейромышечного блока. Таким образом нарушается проведение нервно-мышечного возбуждения и возникает расслабление скелетных мышц[3]. При высоких или повторных дозах сукцинилхолина наступает II фаза (недеполяризующий блок), механизм которого не ясен[2]. Препарат также связывается с Н-холинорецепторами других органов и тканей, что объясняет его побочные эффекты.
Фармакокинетика
правитьДля сукцинилхолина характерно быстрое начало действия (30-60 с) и кратковременный эффект (обычно <10 мин)[4][5]. Поступая в кровоток, сукцинилхолин разрушается путём гидролиза псевдохолинэстеразой и распадается на сукцинилмонохолин и холин, причём настолько быстро, что только примерно 10 % препарата попадает в нервно-мышечный синапс[6]. Затем концентрация препарата в сыворотке крови снижается и молекулы сукцинилхолина начинают диффундировать из комплекса с холинорецепторами в кровоток и нервно-мышечная проводимость восстанавливается. Период полувыведения сукцинилхолина составляет примерно 47 секунд[7].
Сукцинилхолин действует дольше при увеличении дозы, а также нарушении метаболизма — при гипотермии (замедляет гидролиз), низкой концентрации или наследственном дефекте псевдохолинэстеразы[8]. Концентрация псевдохолинэстеразы в сыворотке крови может снижаться при беременности, заболеваниях печени и при воздействии некоторых лекарственных средств[9]. У 2 % больных один аллель гена псевдохолинэстеразы нормальный, второй — патологический (гетерозиготный дефект гена псевдохолинэстеразы), что удлиняет действие препарата до 20-30 мин. У 1 больного из 3000 оба аллеля гена псевдохолинэстеразы патологические (гомозиготный дефект гена псевдохолинэстеразы), в результате чего активность псевдохолинэстеразы значительно снижается, при этом нервно-мышечный блок после введения сукцинилхолина длится около 4-8 ч[1].
Дибукаин — местный анестетик, который ингибирует активность нормальной псевдохолинэстеразы на 80 %, активность псевдохолинэстеразы при гетерозиготном дефекте на 60 %, при гомозиготном дефекте — на 20 %. Процент угнетения активности псевдохолинэстеразы называют дибукаиновым числом. Дибукаиновое число прямо пропорционально функциональной активности псевдохолинэстеразы и не зависит от её концентрации. Поэтому для определения активности псевдохолинэстеразы при лабораторном исследовании измеряют концентрацию фермента в ед/л (второстепенный фактор, определяющий активность) и определяют его качественную полноценность — дибукаиновое число (главный фактор, определяющий активность). При длительном параличе скелетных мышц, который возникает после введения сукцинилхолина больным с патологической псевдохолинэстеразой (синоним — атипичная псевдохолинэстераза), осуществляют ИВЛ до тех пор, пока нервно-мышечная проводимость не восстановится. В некоторых странах (но не в США) применяют термически обработанные препараты холинэстеразы человеческой плазмы. Хотя можно использовать свежезамороженную плазму, риск инфекции обычно превышает пользу от трансфузии.
Показания
правитьСукцинилхолин считают миорелаксантом выбора для стандартной интубации трахеи у взрослых благодаря быстрому началу и короткой продолжительности действия[10]. Хотя рокуроний начинает действовать практически так же быстро, как и сукцинилхолин, он вызывает более длительный блок[11]. Так-же использовался при эндоскопических процедурах (бронхо- и эзофагоскопия, цистоскопия и др.), кратко- временных операциях
Противопоказания
правитьСукцинилхолин противопоказан при миопатиях из-за риска злокачественной гипертермии, должен с осторожностью применяться у детей до 8 лет из-за высокого риска недиагностированной миопатии Дюшена, при гиперкалиемии, повышении внутриглазного давления, при открытой травме глаза, обширных ожогах(спустя 72 часа после травмы) и параличе.
Режим дозирования
правитьУ взрослых доза сукцинилхолина для интубации трахеи составляет 1-1,5 мг/кг внутривенно. Дробное введение сукцинилхолина в низких дозах (10 мг) или длительное капельное введение (1 г на 500—1000 мл раствора), титруемое по эффекту, применяют при некоторых хирургических вмешательствах, требующих кратковременной, но выраженной миорелаксации (например, при эндоскопии ЛОР-органов). К раствору сукцинилхолина часто добавляют метиленовый синий, чтобы не спутать его с другими жидкостями для инфузий. Для предотвращения передозировки препарата и развития II фазы деполяризующего блока следует проводить постоянный мониторинг нервно-мышечной проводимости с помощью стимуляции периферического нерва. Для поддержания миорелаксации более популярен мивакурий — недеполяризующий миорелаксант короткого действия.
Так как сукцинилхолин не растворяется в жирах, его распределение ограничено внеклеточным пространством. Доля внеклеточного пространства на килограмм массы тела у новорождённых и грудных детей больше, чем у взрослых. Следовательно, доза сукцинилхолина у детей выше по сравнению с таковой у взрослых. При в/м введении сукцинилхолина у детей даже доза 4-5 мг/кг не всегда позволяет добиться полной миорелаксации.
Побочные эффекты
правитьСукцинилхолин имеет многочисленные побочные эффекты. Относительно безопасное его применение возможно только при чётком понимании природы этих явлений.
Сердечно-сосудистая система
правитьСукцинилхолин, имея схожую структуру с ацетилхолином, взаимодействует также с холинорецепторами и вне нервно-мышечного синапса. Стимуляция H-холинорецепторов парасимпатических и симпатических ганглиев, а также M-холинорецепторов синоатриального узла в сердце приводит к увеличению или уменьшению артериального давления и частоты сердечных сокращений.
Метаболит сукцинилхолина стимулирует м-холинорецепторы синоатриального узла, что вызывает брадикардию. Хотя к этому эффекту особенно чувствительны дети, после второй дозы сукцинилхолина брадикардия развивается и у взрослых. Для профилактики брадикардии вводят атропин: во всех возрастных группах обязательно перед инъекцией второй дозы сукцинилхолина, а у детей часто и перед первой инъекцией. Дозы атропина: у детей — 0,02 мг/кг в/в, у взрослых — 0,4 мг в/в. Иногда сукцинилхолин вызывает узловую брадикардию и желудочковые эктопические ритмы.
Фасцикуляции
правитьПри введении сукцинилхолина о начале миорелаксации сигнализируют видимые глазом сокращения моторных единиц, которые называются фасцикуляциями. Фасцикуляции можно предотвратить предварительным введением недеполяризующего миорелаксанта в низкой дозе (прекураризация). Так как это взаимодействие препятствует развитию I фазы деполяризующего блока, требуются высокие дозы сукцинилхолина (1,5 мг/кг).
Гиперкалиемия
правитьПри введении сукцинилхолина деполяризация приводит к тому, что из здоровых мышц выделяется калий с увеличением его концентрации в сыворотке крови до 0,5 ммоль/л. При нормальной концентрации калия этот феномен не имеет клинического значения, но при некоторых состояниях (обширные ожоги, травмы, некоторые неврологические заболевания) возникающая гиперкалиемия может привести к нарушению ритма и даже к остановке сердца, которая часто бывает рефрактерна (устойчива) к стандартным реанимационным мероприятиям: для снижения концентрации калия и устранения метаболического ацидоза требуются кальций, инсулин и глюкоза, бикарбонат, катионо-обменная смола, дантролен и даже искусственное кровообращение.
К состоянием высокого риска относят обширные ожоги и травмы, тяжёлую внутрибрюшную инфекцию, травму спинного мозга, энцефалит, инсульт, синдром Гийена-Барре, Тяжёлые формы болезни Паркинсона, столбняк, длительную неподвижность, полинейропатии и миопатии, разрыв артериальной аневризмы головного мозга, закрытые черепно-мозговые травмы, утопление, геморрагический шок с метаболическим ацидозом.
Если травма вызывает денервацию (например, при полном поперечном разрыве спинного мозга денервации подвергаются многие группы мышц), то холинорецепторы формируются на мембранах мышц вне нервно-мышечного синапса, что при введении сукцинилхолина вызывает всеохватывающую деполяризацию мышц и мощный выброс калия в кровоток[12]. Предварительное введение недеполяризующего миорелаксанта не вызывает достоверного предотвращения высвобождения калия и не устраняет угрозы опасных для жизни осложнений. Риск гиперкалиемии достигает максимума на 7-10-й день после травмы, но точные временные параметры периода риска неизвестны[1].
Боль в мышцах
правитьПри введении сукцинилхолина часто возникают миалгии (боли в мышцах) в послеоперационном периоде, что связано с фасцикуляциями и микротравмой мышц вследствие них. На миалгию чаще всего жалуются молодые люди (чаще женщины) после амбулаторных хирургических вмешательств[13]. При беременности, а также в детском и преклонном возрасте риск миалгии уменьшается[14][15][16].
Некоторые исследования говорят о том, что предварительное введение недеполяризующего миорелаксанта или лидокаина (1-1,5 мг/кг) уменьшает вероятность возникновения миалгии[1][13]. Нестероидные противовоспалительные препараты эффективны при лечении миалгии[17].
Повышение давления в полости желудка
правитьФасцикуляции мышц брюшной стенки увеличивают давление в просвете желудка, что в свою очередь приводит к повышению тонуса нижнего пищеводного сфинктера. Следовательно, эти два эффекта взаимопоглощаются, и сукцинилхолин, вероятнее всего, не увеличивает риск возникновения желудочного рефлюкса и лёгочной аспирации. Предварительное введение недеполяризующего миорелаксанта предотвращает как увеличение давления в просвете желудка, так и компенсаторное повышение тонуса нижнего пищеводного сфинктера.
Однако следует соблюдать настороженность к желудочной регургитации и профилактировать её с помощью возвышенного положения головного конца тела и приёма Селика.
Повышение внутриглазного давления
правитьСукцинилхолин повышает внутриглазное давление, что связано с сокращением мышц глазного яблока. При этом у пациентов с травмой глаза увеличивается риск повреждения, в частности при проникающим ранением глаза теоретически существует опасность вытекания стекловидного тела[9]. Некоторые авторы оспаривают это утверждение[18][19]. Предварительное введение недеполяризующего миорелаксанта не всегда предотвращает увеличение внутриглазного давления.
Злокачественная гипертермия
правитьСукцинилхолин — мощный провоцирующий фактор злокачественной гипертермии. Ранним симптомом злокачественной гипертермии часто служит парадоксальное сокращение челюстных мышц после введения сукцинилхолина.
Генерализованные сокращения
правитьПри миотонии введение сукцинилхолина может вызывать миоклонус.
Длительный паралич скелетной мускулатуры
правитьКак уже отмечалось ранее, при низкой концентрации нормальной псевдохолинэстеразы введение сукцинилхолина вызывает умеренное удлинение деполяризующего блока. После введения сукцинилхолина больным с патологической псевдохолинэстеразой возникает длительный паралич скелетных мышц. В отсутствие адекватной респираторной поддержки это осложнение представляет серьёзную опасность.
Повышение внутричерепного давления
правитьСукцинилхолин может увеличивать мозговой кровоток и внутричерепное давление[20]. Это также можно предотвратить с помощью прекураризации и инъекции лидокаина (1,5-2 мг/кг) за 2-3 мин до интубации, а также предварительной ИВЛ в режиме гипервентиляции. Интубация трахеи с неадекватной анестезией и миорелаксацией увеличивает внутричерепное давление значительно сильнее, чем сукцинилхолин[21].
Хранение
правитьХранение: список А. В защищённом от света месте (в холодильнике) при температуре от +2 °C до +8 °C (для предупреждения спонтанного гидролиза).
Примечания
править- ↑ 1 2 3 4 Морган-мл. Дж. Э., Мэгид С. М., перевод Бунятин А. А., Клиническая анестезиология: книга первая, Изд. Москва, Бином, 2008
- ↑ 1 2 Богданов А. А., врач анестезиолог, Wexham Park and Heatherwood Hospitals, Berkshire, UK. Сукцинилхолин – друг или враг? Дата обращения: 1 декабря 2011. Архивировано 13 октября 2012 года.
- ↑ Cahalan, Michael D.; Barash, Paul G.; Cullen, Bruce F.; Stoelting, Robert K. Handbook of Clinical Anesthesia. — Hagerstwon, MD: Lippincott Williams & Wilkins[англ.], 2009. — С. 143—144. — ISBN 0-7817-8948-6.
- ↑ Curran M.J., Donati F., Bevan D.R. Onset and recovery of atracurium and suxamethonium-induced neuromuscular blockade with simultaneous train-of-four and single twitch stimulation (англ.) // Br J Anaesth[англ.] : journal. — 1987. — August (vol. 59, no. 8). — P. 989—994. — PMID 3651281.
- ↑ Viby-Mogensen J. Correlation of succinylcholine duration of action with plasma cholinesterase activity in subjects with the genotypically normal enzyme (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 1980. — December (vol. 53, no. 6). — P. 517—520. — PMID 7457973. (недоступная ссылка)
- ↑ Gissen A.J., Katz R.L., Karis J.H., Papper E.M. Neuromuscular block in man during prolonged arterial infusion with succinylcholine (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 1966. — Vol. 27, no. 3. — P. 242—249. — PMID 5937158.
- ↑ Torda T.A., Graham G.G., Warwick N.R., Donohue P. Pharmacokinetics and pharmacodynamics of suxamethonium (англ.) // Anaesth Intensive Care : journal. — 1997. — June (vol. 25, no. 3). — P. 272—278. — PMID 9209610.
- ↑ Mikhail, Maged S.; Murray, Michael P. Morgan's Clinical anesthesiology. — New York: Lange Medical Books/McGraw Hill Medical Pub. Division, 2006. — ISBN 0-07-110515-8.
- ↑ 1 2 Бунятян А.А. Рациональная фармакотерапия в анестезиологии. — Литерра, 2006. — С. 181—183. — 800 с. — ISBN 5-98216-040-7.
- ↑ Miller R. Will succinylcholine ever disappear? (англ.) // Anesth. Analg.[англ.] : journal. — 2004. — June (vol. 98, no. 6). — P. 1674—1675. — PMID 15155326.
- ↑ Perry J.J., Lee J.S., Sillberg V.A., Wells G.A. Rocuronium versus succinylcholine for rapid sequence induction intubation (англ.) // Cochrane Database of Systematic Reviews : journal. — 2008. — No. 2. — P. CD002788. — doi:10.1002/14651858.CD002788.pub2. — PMID 18425883.
- ↑ Martyn J.A., Richtsfeld M. Succinylcholine-induced hyperkalemia in acquired pathologic states: etiologic factors and molecular mechanisms (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2006. — January (vol. 104, no. 1). — P. 158—169. — PMID 16394702. Архивировано 28 августа 2014 года.
- ↑ 1 2 Wong S.F., Chung F. Succinylcholine-associated postoperative myalgia (англ.) // Anaesthesia[англ.]. — Wiley-Blackwell, 2000. — February (vol. 55, no. 2). — P. 144—152. — PMID 10651675.
- ↑ Thind G.S., Bryson T.H. Single dose suxamethonium and muscle pain in pregnancy (англ.) // Br J Anaesth[англ.] : journal. — 1983. — August (vol. 55, no. 8). — P. 743—745. — PMID 6882612.
- ↑ BUSH G.H., ROTH F. Muscle pains after suxamethonium chloride in children (англ.) // Br J Anaesth[англ.] : journal. — 1961. — March (vol. 33). — P. 151—155. — PMID 13689350.
- ↑ FOSTER C.A. Muscle pains that follow administration of suxamethonium (англ.) // Br Med J : journal. — 1960. — July (vol. 2, no. 5191). — P. 24—5. — PMID 13824106. — PMC 2096870.
- ↑ Schreiber J.U., Lysakowski C., Fuchs-Buder T., Tramèr M.R. Prevention of succinylcholine-induced fasciculation and myalgia: a meta-analysis of randomized trials (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2005. — October (vol. 103, no. 4). — P. 877—884. — PMID 16192781. Архивировано 7 июля 2012 года.
- ↑ Vachon C.A., Warner D.O., Bacon D.R. Succinylcholine and the open globe. Tracing the teaching (англ.) // Anesthesiology[англ.] : journal. — Lippincott Williams & Wilkins[англ.], 2003. — July (vol. 99, no. 1). — P. 220—223. — PMID 12826863. (недоступная ссылка)
- ↑ Libonati M.M., Leahy J.J., Ellison N. The use of succinylcholine in open eye surgery (англ.) // Anesthesiology[англ.]. — Lippincott Williams & Wilkins[англ.], 1985. — May (vol. 62, no. 5). — P. 637—640. — PMID 3994030.
- ↑ Minton M.D., Grosslight K., Stirt J.A., Bedford R.F. Increases in intracranial pressure from succinylcholine: prevention by prior nondepolarizing blockade (англ.) // Anesthesiology[англ.]. — Lippincott Williams & Wilkins[англ.], 1986. — August (vol. 65, no. 2). — P. 165—169. — PMID 2874752.
- ↑ Cahalan, Michael D.; Barash, Paul G.; Cullen, Bruce F.; Stoelting, Robert K. Clinical anesthesia. — Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2009. — С. 427—429. — ISBN 0-7817-8763-7.
Для улучшения этой статьи по фармакологии желательно:
|