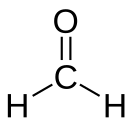
Формальдегид
Формальдеги́д, метана́ль (химическая формула — CH2O или HCHO) — органическое соединение, возглавляющее класс алифатических альдегидов.
| Формальдегид[1][2] | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Муравьи́ный альдеги́д, формальдеги́д, формали́н; карбони́ла гидри́д | ||
| Хим. формула | CH2O | ||
| Рац. формула | HCHO | ||
| Физические свойства | |||
| Состояние | Газ | ||
| Молярная масса | 30,03 г/моль | ||
| Плотность | 0,8153 г/см3 (–20 °C) | ||
| Энергия ионизации | 10,88 ± 0,01 эВ[3] и 10,87 эВ[4] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | –118 °C | ||
| • кипения | –19 °C | ||
| Пределы взрываемости | 7 ± 1 об.%[3] | ||
| Критическая точка | |||
| • температура | 137,2–141,2 °C | ||
| • давление | 6,784–6,637 МПа | ||
| Уд. теплоёмк. | 35,425 Дж·моль–1·K–1 Дж/(кг·К) | ||
| Энтальпия | |||
| • образования | −115,9 кДж/моль | ||
| • растворения | –62 кДж/моль (вода, 23 °С) | ||
| Давление пара | 1 ± 1 атм[3] | ||
| Структура | |||
| Дипольный момент | 7,8E−30 Кл·м[4] | ||
| Классификация | |||
| Рег. номер CAS | 50-00-0 | ||
| PubChem | 712 | ||
| Рег. номер EINECS | 200-001-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E240 | ||
| RTECS | LP8925000 | ||
| ChEBI | 16842 | ||
| Номер ООН | 2209 | ||
| ChemSpider | 692 | ||
| Безопасность | |||
| Предельная концентрация | 0,5 мг/м3 | ||
| ЛД50 | 100 мг/кг (крысы, орально) | ||
| Токсичность | Высокотоксичен | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При стандартных условиях формальдегид — это бесцветный газ с резким неприятным (тяжёлым, удушающим) запахом. Является ирритантом, контаминантом и канцерогеном. Ядовит (в больших концентрациях). Зарегистрирован в качестве пищевой добавки E240.
Физические свойства править
Формальдегид — это алифатический альдегид метанола и муравьиной кислоты, представляющий собой бесцветный газ с резким запахом, немного тяжелее воздуха. Даже в низких концентрациях он раздражает кожу, глаза и носоглотку и обнаруживается по запаху в количестве 0,05—1 м. д. Сжижается формальдегид при −19,2 °С, превращаясь в жидкость с плотностью 0,8153 г/см3. Ниже −118 °С формальдегид превращается в белую пасту. Жидкий и газообразный формальдегид при температурах до 80 °С активно полимеризуется, однако между 80 и 100 °С газообразный формальдегид устойчив[2].
Жидкий формальдегид во всех соотношениях смешивается с неполярными растворителями: спиртами, хлороформом, этилацетатом, диэтиловым эфиром и толуолом. При повышении температуры его растворимость уменьшается и начинают преобладать испарение и полимеризация. В петролейном эфире растворимость низкая, а полярные растворители либо катализируют полимеризацию, либо присоединяются к формальдегиду[2].
| Величина | Значение |
|---|---|
| Ст. энергия Гиббса образования, ΔG | −110 кДж/моль (г) |
| Ст. энтропия образования, S | 218,66 Дж/моль·K (г) |
| Ст. мольная теплоёмкость, Cр | 35,35 Дж/моль·K (г) |
| Энтальпия кипения, ΔHкип. | 23,3 кДж/моль |
Химические свойства править
Из-за низкой электронной плотности на атоме углерода формальдегид легко вступает в различные реакции. По реакционной способности он превосходит другие альдегиды и алифатические кетоны.
Окисление и восстановление править
Формальдегид восстанавливается водородом до метанола в присутствии никеля, платины, меди и других катализаторов. До муравьиной кислоты либо CO2 и воды его окисляют перманганатом калия, дихроматом калия и азотной кислотой. Также он взаимодействует с солями многих металлов (серебра, платины, золота, висмута и др.), осаждая металлы из растворов и окисляясь при этом до муравьиной кислоты[1]. При нагревании до 150 °С формальдегид разлагается до метанола и углекислого газа, а выше 300 °С — до CO и водорода[5].
Реакции присоединения править
Формальдегид вступает в типичные для альдегидов реакции нуклеофильного присоединения. При присоединении спиртов он образует ацетали, с сероводородом он даёт тритиан, а с HCN в присутствии щёлочи — циангидрин[1]. С гидросульфитом натрия он даёт бисульфитное производное[1].
Из формальдегида и ацетилена по реакции Реппе получают бутадиен. В присутствии извести формальдегид превращается в углеводы, преимущественно гексозы. Присоединение аммиака даёт гексаметилентетрамин, а при использовании первичных аминов образуются тримерные производные соответствующих оснований Шиффа. Также формальдегид является ключевым компонентом реакции Манниха. Даёт он производные и с другими азотистыми нуклеофилами: гидроксиламином, гидразинами и семикарбазидом. При этом образуются соответственно оксим, гидразоны и семикарбазон[1][5].
В водных растворах формальдегид легко присоединяет воду и на 99,9 % находится в них в гидратированной форме, неустойчивой в свободном виде[1].
Реакции конденсации править
Формальдегид вступает в альдольную конденсацию и аналогичные превращения. В присутствии концентрированной щёлочи он даёт реакцию Канниццаро, превращаясь в метанол и соль муравьиной кислоты, а с другими альдегидами — перекрёстную реакцию Канниццаро, выступая как восстановитель и превращаясь в соль муравьиной кислоты. С ацетальдегидом в присутствии гидроксида кальция он образует пентаэритрит, а в газовой фазе при 285 °С — акролеин. Также формальдегид вступает в реакцию Тищенко с образованием метилформиата[1][5].
Реакции полимеризации править
Безводный формальдегид легко подвергается полимеризации, поэтому коммерчески он недоступен. Полимеризация катализируется полярными примесями: кислотами, щелочами, водой и др. В водных растворах формальдегид также склонен к полимеризации, поэтому в коммерческие партии добавляют метанол и другие стабилизаторы[5]. При упаривании водных растворов образуется параформ[1].
В щелочной среде формальдегид реагирует с мочевиной, давая монометилольные и диметилольные производные, которые конденсируются с образованием карбамидоформальдегидной смолы. Аналогично он реагирует с меламином, образуя меламиноформальдегидные смолы. В присутствии кислот и оснований формальдегид реагирует с фенолом, давая фенолформальдегидные смолы[1].
Получение править
В промышленности править
Впервые формальдегид был синтезирован в 1859 году А. М. Бутлеровым. В 1867 году Гофман также синтезировал формальдегид, пропуская пары метанола и воздух над нагретой платиновой спиралью, и идентифицировал полученный продукт. В 1882 году Кекуле описал метод синтеза чистого формальдегида[2].
В том же году Толленс научился влиять на выход реакции изменением соотношения метанола и воздуха, а в 1886 году платину заменили более эффективной медью. В 1889 году немецкая фирма Mercklin und Lösekann открыла первое промышленное производство формальдегида. В 1910 году другая фирма Hugo Blank запатентовала использование в этом процессе серебряного катализатора. В 1905 году формальдегид стала производить компания BASF, используя для этого непрерывный процесс и серебряный катализатор. Мощности этого производства позволяли получать 30 кг 30%-го раствора в день[2].
Формальдегид в промышленности получают из метанола тремя способами:
- частичным окислением и дегидрированием под действием воздуха в присутствии кристаллов серебра, водяного пара и избытка метанола при 650—720 °С (BASF);
- частичным окислением и дегидрированием под действием воздуха в присутствии кристаллического серебра или серебряной сетки, водяного пара и избытка метанола при 600—650 °С;
- окислением избытком воздуха в присутствии катализатора на основе оксидов железа, молибдена и ванадия при 250—400 °С (Формокс-процесс)[6].
Окисление метанола в формальдегид проводится с использованием серебряного катализатора при температуре 650—720 °C и атмосферном давлении. Это хорошо освоенный технологический процесс, и 80 % формальдегида получается именно по этому методу. Его можно представить в виде трёх параллельных реакций[7]:
Дегидрирование метанола (реакция 1) сильно зависит от температуры: при 400 °С конверсия составляет 50 %, при 500 °С — 90 %, а при 700 °С — 99 %. Реакция имеет первый порядок, поэтому скорость образования формальдегида зависит от концентрации доступного кислорода и от времени нахождения кислорода на поверхности катализатора. Полный механизм этого процесса пока не установлен[7]. В процессе, используемом компанией BASF, конечный водный раствор содержит 40-55 мас. % формальдегида, 1-2 мас. % метанола и 0,01 мас. % муравьиной кислоты. Выход по формальдегиду составляет 86,5-90,5 %[8].
Компании ICI, Borden, Degussa проводят дегидрирование и окисление метанола при более низкой температуре. Это позволяет избежать образования побочных продуктов, однако конверсия в данном случае неполная, и получаемый раствор формальдегида необходимо перегнать для отделения остатков метанола. Выход такого процесса составляет 87-92 %[9].
Окисление на железо-молибденовых катализаторах (Формокс-процесс) даёт практически полную конверсию метанола (95-99 %). Конечный продукт получается в виде водного раствора с концентрацией 55 мас. % формальдегида и 0,5-1,5 мас. % метанола. В целом, выход процесса составляет 88-92 %[10].
В лаборатории править
Для получения формальдегида в лабораторных условиях метанол дегидрируют над медью, разлагают формиат цинка либо деполимеризуют параформ[1].
Применение править
Основная часть формальдегида используется для производства фенолформальдегидных, карбамидформальдегидных и меламинформальдегидных смол, которые далее идут на производство ДСтП, фанеры и мебели. Также из них производят формовочные материалы. Полученные смолы находят применение в качестве вспомогательных реагентов в текстильной и кожевенной промышленности, производстве резины и цемента. Небольшая доля карбамидоформальдегидных смол используется для получения вспененных пластмасс[11].
Примерно 40 % производимого формальдегида расходуется на производство других химикатов. В этом смысле он представляет собой ценный одноуглеродный «строительный блок». Его применяют в производстве бутандиола-1,4, триметилолпропана, неопентилгликоля, пентаэритрита, уротропина. Также формальдегид используется для получения нитрилотриуксусной кислоты и ЭДТА. Всё больше возрастает потребность в метилендифенилдиизоцианате. Формальдегид является важным блоком в синтезе красителей, дубящих средств, лекарств, отдушек, парфюмерии и др.[11]
Непосредственное применение находит лишь очень малая часть формальдегида. Он используется как ингибитор коррозии, в полировке зеркал и гальванопокрытии, в производстве печатных схем и для проявки плёнки. Большая часть формальдегида расходуется на медицинские цели: для консервации биологических материалов и дезинфекции. Как антимикробный реагент, формальдегид имеет широкий спектр применения, хоть и проявляет некоторые побочные эффекты (канцероген)[11].
Использование формальдегида в составе косметических средств править
Директивой 76/768 ЕЭС допускается применение формальдегида в качестве консерванта в количестве до 0,1 % в составе косметических средств, предназначенных для гигиены полости рта, и до 0,2 % в прочих косметических препаратах.
В фармакологии препараты, содержащие до 0,5 % формальдегида, применяются для снижения потливости без каких-либо ограничений, и только при применении мази, содержащей 5 % этого вещества, рекомендуется не наносить её на кожу лица.[12] Запрещается применять для консервации средств в аэрозольной упаковке, спреев. Продукция должна иметь предупреждение «содержит формальдегид», если содержание формальдегида в готовой продукции превышает 0,05 %. С точки зрения спектра противомикробной активности, формальдегид проявляет активность в отношении грамположительных, грамотрицательных бактерий, дрожжеподобных и плесневых грибов. В то же время формальдегид и парабены снижают противомикробные свойства в присутствии белков.[13] Наряду с этим установлено улучшение физико-механических свойств волоса после обработки его формалином. Кератин с формальдегидом может взаимодействовать по-разному. Формальдегид может реагировать с S-Н-группами, образуя связи S-СН2-S, с NH2-группами боковых цепей и т. д. Например, прочная связь NH-СН образуется при взаимодействии формальдегида с амидогруппами остатков дикарбоновых кислот и аминогруппами гуанидиновых групп аргинина.[14]
В литературе сведения о влиянии разбавленных растворов формальдегида на кожу человека практически отсутствуют. Известно, что если выдержать ухо кролика в формалине (37%-й раствор формальдегида) в течение 30 минут, то оно покраснеет и начнёт шелушиться, а впоследствии полностью восстановится (регенерирует).
Так как формальдегид в развитых странах используется исключительно в композиции косметических препаратов, не остающихся на коже, вероятность возникновения кожной реакции была рассчитана для случаев использования шампуня, содержащего в качестве консерванта 0,1 % формальдегида. Расчёт показал, что нежелательная кожная реакция при применении такого шампуня возникнет только у 1 человека из 75 000. При этом в действительности эта цифра будет ещё менее значимой, поскольку при проведении расчётов не учитывался ряд факторов, не поддающихся точному учёту, но неопровержимо снижающих эту вероятность. Во-первых, расчёт основывался на базовых данных по содержанию формальдегида непосредственно на коже человека. При мытьё волос в непосредственном контакте с кожей находится лишь незначительная часть формальдегида, находящегося в шампуне. Во-вторых, в связи с невысокой стойкостью формальдегида в водных растворах (испарение), его концентрация с течением времени понижается.[12]
Безопасность править
Пожарная безопасность править
Категория взрывоопасности IIB по ГОСТ Р 51330.11-99, группа взрывоопасности Т2 по ГОСТ Р 51330.5-99. Концентрационные пределы воспламенения 7—73 % об.; Класс опасности — II (вещества высокоопасного класса)[15]; температура самовоспламенения — 435 °C[16].
Воздействие на организм человека править
Предельно допустимые концентрации (ПДК) формальдегида:[17][18][19]
С 25 мая 2014 г. вступило в силу Постановление Главного государственного санитарного врача Российской Федерации, согласно которому установлены следующие значения ПДКм.р. = 0,05 мг/м3, ПДКс.с. = 0,01 мг/м3. Максимальная разовая величина ПДК формальдегида увеличена с 0,035 до 0,05 мг/м3, среднесуточный объём ПДК — с 0,003 до 0,01 мг/куб. м. Данному веществу присвоен первый класс опасности (ранее был второй).[15][20]
Смертельная доза 40 % водного раствора формальдегида (формалина) составляет 10—50 г.
Формальдегид токсичен: приём внутрь 60—90 мл является смертельным. Симптомы отравления: бледность, упадок сил, бессознательное состояние, депрессия, затруднённое дыхание, головная боль, нередко судороги.
При остром ингаляционном отравлении: конъюнктивит, острый бронхит, вплоть до отёка лёгких. Постепенно нарастают признаки поражения центральной нервной системы (головокружение, чувство страха, шаткая походка, судороги). При отравлении через рот: ожог слизистых оболочек пищеварительного тракта (жжение, боль в глотке, по ходу пищевода, в желудке, рвота кровавыми массами, понос), геморрагический нефрит, анурия. Возможны отёк гортани, рефлекторная остановка дыхания.
Хроническое отравление у работающих с техническим формалином проявляется похудением, диспепсическими симптомами, поражением центральной нервной системы (психическое возбуждение, дрожание, атаксия, расстройства зрения, упорные головные боли, плохой сон). Описаны органические заболевания нервной системы (таламический синдром), расстройства потоотделения, температурная асимметрия. Отмечены случаи бронхиальной астмы.
В условиях воздействия паров формалина (например, у рабочих, занятых изготовлением искусственных смол), а также при непосредственном контакте с формалином или его растворами наблюдаются, в особенности в первые дни работы, выраженные дерматиты лица, предплечий и кистей, поражения ногтей (их ломкость, размягчение). Возможны дерматиты и экземы аллергического характера. После перенесённого отравления чувствительность к формалину повышается. Имеются сведения о неблагоприятном влиянии на специфические функции[какие?] женского организма[21][22].
Формальдегид внесён в список канцерогенных веществ ГН 1.1.725-98 в разделе «вероятно канцерогенные для человека», при этом доказана его канцерогенность для животных.[23][24][25]
Наибольшую опасность формальдегид представляет при отравлении метанолом, в ходе метаболизма которого он образуется наряду с муравьиной кислотой, вызывает атрофию зрительного нерва и сетчатки, блокирует перенос кислорода эритроцитами и разрушает их, вступает в реакцию с белками, нарушает работу ЦНС и вызывает её повреждение.
Экологическая безопасность править
Формальдегид повсеместно присутствует в атмосфере, где появляется из-за сгорания и разложения (в том числе фотохимического) органических веществ и материалов. Одновременно формальдегид постоянно подвергается разложению до углекислого газа под действием солнечного света и оксидов азота, а также вымывается из воздуха дождём и затем перерабатывается бактериями (например, Escherichia coli или Pseudomonas fluorescens). Основным источником формальдегида в атмосфере является фотохимическое окисление и неполное сгорание углеводородов. Формальдегид входит в состав выхлопных газов и газовых выбросов заводов и мусоросжигательных фабрик[26].
В замкнутых пространствах формальдегид накапливается из-за курения табака, выделений из карбамидоформальдегидных и прочих смол, наличия открытого огня и использования дезинфицирующих средств.[26].
Законодательство многих стран регулирует предельно допустимую концентрацию формальдегида в помещениях, а также выбросах заводов[26].
Экономические аспекты править
Формальдегид является одним из наиболее ценных продуктов промышленности и используется в производстве тысяч других промышленных и потребительских продуктов. По экономическим причинам его редко можно заменить некими аналогами, а его токсичность была исследована даже лучше, чем токсичность этих аналогов. В 2011 году мировое производство формальдегида составило 18 млн тонн в год (рассчитано на 100%-ый формальдегид). Крупнейшими производителями являются компании:
- Momentive Specialties Chemicals (1,5 млн тонн в год);
- BASF (0,5 млн тонн в год);
- Dynea (0,4 млн тонн в год)[27].
Три страны занимают 45 % рынка:
Годовое потребление формальдегида (в расчёте на 100%-ый) составляет 13,1 млн тонн. Из них Азия потребляет 50,2 % от общего количества, Западная Европа — 22,3 %, Северная Америка — 16,2 %, Центральная и Восточная Европа — 5,2 %, Южная Америка — 3,6 %, Ближний Восток — 2,0 %, Африка — 0,5 %[27].
Основная масса формальдегида расходуется на производство полимеров: аминополимеры — 34 %, фенольные полимеры — 12 %, полиацетальные полимеры — 9 %[27].
Примечания править
- ↑ 1 2 3 4 5 6 7 8 9 10 Химическая энциклопедия, 1998.
- ↑ 1 2 3 4 5 Ullmann, 2016, p. 1–2.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0293.html
- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 1 2 3 4 Ullmann, 2016, p. 5–6.
- ↑ Ullmann, 2016, p. 6.
- ↑ 1 2 Ullmann, 2016, p. 7.
- ↑ Ullmann, 2016, p. 8.
- ↑ Ullmann, 2016, p. 9–10.
- ↑ Ullmann, 2016, p. 10–11.
- ↑ 1 2 3 Ullmann, 2016, p. 19–20.
- ↑ 1 2 О консервантах без предрассудков. Дата обращения: 1 июня 2012. Архивировано 21 мая 2012 года.
- ↑ Принципы подбора консервантов для косметической продукции. Дата обращения: 1 июня 2012. Архивировано 22 января 2013 года.
- ↑ Изменения кератина при действии формальдегида, солей металлов и красителей. Дата обращения: 1 июня 2012. Архивировано из оригинала 2 октября 2012 года.
- ↑ 1 2 Постановление Главного государственного санитарного врача Российской Федерации от 7 апреля 2014 г. N 27 г. Москва "О внесении изменения N 10 в ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест». Дата обращения: 12 июля 2014. Архивировано 25 октября 2014 года.
- ↑ Ullmann, 2016, p. 2.
- ↑ s:Гигиенические нормативы ГН 2.2.5.1313—03. «Предельно допустимые концентрации (ПДК) вредных веществ воздухе рабочей зоны»
- ↑ s:Гигиенические нормативы ГН 2.1.6.1338—03. «Предельно допустимые концентрации (ПДКр) загрязняющих веществ в атмосферном воздухе населённых мест»
- ↑ s:Гигиенические нормативы ГН 2.1.5.1315—03. «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования»
- ↑ Постановление Главного государственного санитарного врача РФ от 7 апреля 2014 г. № 27 “О внесении изменения № 10 в ГН 2.1.6.1338-03 “Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест” (не вступило в силу). www.garant.ru. Дата обращения: 5 сентября 2019. Архивировано 5 сентября 2019 года.
- ↑ Медицинский информационный сервер. Отравление формальдегидом. Дата обращения: 23 июня 2011. Архивировано 9 ноября 2011 года.
- ↑ В. Ф. Крамаренко. Токсикологическая химия. — К.: Выща шк., 1989. — 447 с. — 6000 экз. — ISBN 5-11-000148-0.
- ↑ Перечень веществ, продуктов, производственных процессов, бытовых и природных факторов, канцерогенных для человека Архивная копия от 16 октября 2011 на Wayback Machine, Прил. 2 к нормативам ГН 1.1.725-98 от 23 декабря 1998 г. № 32.
- ↑ Этот же перечень Архивная копия от 22 января 2008 на Wayback Machine, Лаборатория аналитической экотоксикологии института проблем экологии и эволюции им. А. Н. Северцова РАН.
- ↑ Территориальное управление Роспотребнадзора по Тульской области Архивная копия от 11 января 2012 на Wayback Machine.
- ↑ 1 2 3 Ullmann, 2016, p. 14–17.
- ↑ 1 2 3 4 Ullmann, 2016, p. 20–21.
Литература править
- Розанов В. Н. Формальдегид // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 115–116. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Franz A. W., Kronemayer H., Pfeiffer D., Pilz R. D., Reuss G., Disteldorf W., Gamer A. O., Hilt A. Formaldehyde (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2016. — doi:10.1002/14356007.a11_619.pub2.