Гармин
Гарми́н — бета-карболиновый алкалоид, впервые выделен из гармалы (Peganum harmala) (до 3 % от сухого веса корней). Обратимый ингибитор MAO и стимулятор центральной нервной системы. Запрещён в РФ в связи постановлением правительства Российской Федерации от 19 декабря 2018 г. № 1598 МОСКВА. О внесении изменений в некоторые акты Правительства Российской Федерации в связи с совершенствованием контроля за оборотом наркотических средств и психотропных веществ. Выдержка: "...после позиции "4-MTA (альфа-метил-4-метилтиофенетиламин)" дополнить позициями следующего содержания: "1-Метил-7-метокси-9Н-пиридо[3,4-b]индол (гармин)..."
| Гармин | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
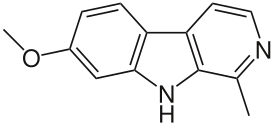
4,9-дигидро-7-метокси-1-метил-3H-пиридо[3,4-b]индол |
| Хим. формула | C13H12N2O |
| Физические свойства | |
| Молярная масса | 212.25 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 264 °C[1] |
| Классификация | |
| Рег. номер CAS | 442-51-3 |
| PubChem | 5280953 |
| Рег. номер EINECS | 207-131-4 |
| SMILES | |
| InChI | |
| ChEBI | 28121 |
| ChemSpider | 4444445 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
правитьГармин является основанием и образует кристаллические соли с сильными кислотами. Как и все карболины, гармин флуоресцирует при облучении ультрафиолетом, для протонированной формы гармина при низких pH характерна синяя флуоресценция, для основания — желто-зеленая, интервал перехода лежит в пределах pH 7.2-8.9.
Гармин восстанавливается натрием в этаноле до тетрагидрогармина, и бромируется до тетрабромгармина. При кипячении с дымящейся соляной кислотой происходит расщепление метоксильной связи с образованием гармалола. Метильная группа гармина, находящаяся в α-положении к пиридиновому азоту, активирована: гармин вступает в реакции конденсации с ароматическими альдегидами с образованием бензилиденовых производных.
Окисление гармина сильными окислителями ведет к деградации бензольного фрагмента молекулы: так, при окислении хромовым ангидридом в уксусной кислоте гармин окисляется до гарминовой кислоты (7-метил-1H-пирроло[2,3-c]пиридин-2,3-дикарбоновой кислоты).
Использование
правитьКак МАО-ингибитор гармин способен ингибировать фермент моноаминоксидазу. Он ингибирует МАО-А, но не влияет на МАО-Б[2]. Гармин не был предметом многочисленных клинических исследований лечения депрессий, что ограничивает его правовой статус во многих странах.
Традиционно растения P. harmala and B. caapi используются из-за своего психоактивного эффекта. В частности, существует традиция употребления B. caapi в сочетании с растениями, содержащими диметилтриптамин, например, в составе напитка аяуаска. Обычно ДМТ не активен, когда принимается в пероральной форме, но пользователи сообщают о весьма различных эффектах в таких напитках.
Совместно с изотопом углерода 11C гармин используется в позитронно-эмиссионной томографии[3].
Было установлено, что гармин, найденный в корне кислицы клубненосной, обладает инсектицидными свойствами[4].
Кроме того, гармин показал себя как цитостатический препарат по отношению к клеткам HL60 и K562[5].
Эффекты
правитьГармин и аналогичные алкалоиды — галлюциногены, стимуляторы ЦНС, кратковременные ингибиторы МАО (в 100 раз сильнее ипрониазида, но действуют лишь несколько часов).
Отравление гармином вызывает брадикардию, снижение АД, тремор, тошноту, рвоту.
Летальная доза 38 мг/кг (крысы, внутривенно)[6].
Использовался для лечения последствий эпидемического энцефалита, дрожательного паралича и болезни Паркинсона. В настоящее время гармин в связи с появлением более эффективных и безопасных ингибиторов МАО[каких?] исключен из номенклатуры лекарственных средств[7][неавторитетный источник].
Природные источники
правитьЭтот раздел не завершён. |
Гармин — распространенный алкалоид, обнаружен в растениях, принадлежащих к семействам Zygophyllaceae, Malpighiaceae. Содержится в Banisteriopsis caapi (из которого изготавливают южноамериканский галлюциноген «яхе»), Peganum harmala (сирийская рута).
Перспективные исследования
правитьОбнаружено, что гармин-опосредованное ингибирование DYRK1A (dual-specificity tyrosine-regulated kinase-1a) увеличивает репликацию бета-клеток поджелудочной железы человека.[8] В сочетании с эксендином-4, являющимся агонистом рецептора GLP1 (GLP1R) гармин продемонстрировал способность в несколько раз повысить массу бета-клеток поджелудочной железы человека трансплантированных мышам с иммунодефицитом.[9] Для лечения диабета таким способом необходимо сделать так чтобы иммунная система перестала атаковать новые бета-клетки по мере их образования.[10]
См. также
правитьПримечания
править- ↑ Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // (unknown type) — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ Abstract Gerardy J, «Effect of moclobemide on rat brain monoamine oxidase A and B: comparison with harmaline and clorgyline.», Department of Pharmacology, University of Liège, Sart Tilman, Belgium. Дата обращения: 16 декабря 2009. Архивировано из оригинала 26 мая 2011 года.
- ↑ Nathalie Ginovart, Jeffrey H. Meyer, Anahita Boovariwala, Doug Hussey, Eugenii A. Rabiner, Sylvain Houle and Alan A. Wilson. Positron emission tomography quantification of [11C]-harmine binding to monoamine oxidase-A in the human brain (англ.) // Journal of Cerebral Blood Flow & Metabolism[англ.] : journal. — 2006. — Vol. 26. — P. 330—344. — doi:10.1038/sj.jcbfm.9600197.
- ↑ Pal Bais, Harsh; Sang-Wook Parka, Frank R. Stermitzb, Kathleen M. Halliganb, Jorge M. Vivancoa. Exudation of fluorescent b-carbolines from Oxalis tuberosa L. roots (неопр.) // Phytochemistry. — 2002. — 18 June (т. 61). — С. 539—543. — doi:10.1016/S0031-9422(02)00235-2. Архивировано 5 сентября 2008 года. Архивированная копия. Дата обращения: 16 декабря 2009. Архивировано из оригинала 5 сентября 2008 года.
- ↑ Jahaniani, F. Xanthomicrol is the main cytotoxic component of Dracocephalum kotschyii and a potential anti-cancer agent (англ.) // Phytochemistry[англ.] : journal. — Vol. 66. — P. 1581. — doi:10.1016/j.phytochem.2005.04.035. Архивировано 26 июня 2008 года.
- ↑ [www.erowid.org/plants/syrian_rue/syrian_rue_chemistry.shtml Syrian Rue Chemistry]. Дата обращения: 16 декабря 2009. Архивировано 14 декабря 2009 года.
- ↑ Eric Yarnell, Kathy Abascal. Botanical Treatments for Depression (неопр.) // Alternative & Complementary Therapies. — 2001. — April (т. 7, № 3). — С. 138—143. — doi:10.1089/10762800151125056.
- ↑ Wang, P., Alvarez-Perez, J. C., Felsenfeld, D. P., Liu, H., Sivendran, S., Bender, A., ... & Stewart, A. F. (2015). Induction of human pancreatic beta cell replication by inhibitors of dual specificity tyrosine regulated kinase. Nature medicine, 21(4), 383. PMID 25751815 PMC 4690535 doi:10.1038/nm.3820
- ↑ Rosselot С. et al., (2024). Harmine and exendin-4 combination therapy safely expands human β cell mass in vivo in a mouse xenograft system. Sci. Transl. Med. 16,eadg3456 doi:10.1126/scitranslmed.adg3456
- ↑ Mount Sinai and City of Hope Scientists First to Demonstrate a Combination Treatment Can Increase Human Insulin-Producing Cells in Vivo. Press Release. City of Hope. Mount Sinai.
Литература
править- Manske, R H; H L Holmes. The Alkaloids: Chemistry and Physiology (неопр.). — Academic Press, 1952. — ISBN 9780124695023.
Ссылки
править- «Lycaeum > Leda >Harmine» leda.lycaeum.org.
- Harmine found in Oxalis tuberosa
Это заготовка статьи по органической химии. Помогите Википедии, дополнив её. |
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |