Серная кислота
Се́рная кислота́ (лат. Acidum sulphuricum, химическая формула — H2SO4) — сильная неорганическая кислота, отвечающая высшей степени окисления серы (+6). Зарегистрирована как пищевая добавка E513.
| Серная кислота | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
Серная кислота, тетраоксосульфат(VI) водорода | ||
| Традиционные названия | Купоросное масло | ||
| Хим. формула | H2SO4 | ||
| Рац. формула | H2SO4 | ||
| Физические свойства | |||
| Состояние | Жидкость | ||
| Молярная масса | 98,078 ± 0,006 г/моль | ||
| Плотность | 1,8356 г/см³ | ||
| Динамическая вязкость | 21 мПа·с[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | +10,38 °C | ||
| • кипения | +337 °C | ||
| • разложения | +450 °C | ||
| Удельная теплота плавления | 10,73 Дж/кг | ||
| Давление пара | 0,001 ± 0,001 мм рт.ст.[3] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | -3 | ||
| Растворимость | |||
| • в воде | смешивается в любых пропорциях | ||
| Оптические свойства | |||
| Показатель преломления | 1.397 | ||
| Структура | |||
| Дипольный момент | 2.72 Д | ||
| Классификация | |||
| Рег. номер CAS | 7664-93-9 | ||
| PubChem | 1118 | ||
| Рег. номер EINECS | 231-639-5 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E513 | ||
| RTECS | WS5600000 | ||
| ChEBI | 26836 | ||
| Номер ООН | 1830 | ||
| ChemSpider | 1086 | ||
| Безопасность | |||
| Предельная концентрация | 1 мг/м3 | ||
| ЛД50 | 100 мг/кг | ||
| Токсичность | 2-й класс опасности[1], общетоксическое действие. | ||
| Краткие характер. опасности (H) |
H290, H314 |
||
| Меры предостор. (P) |
P280, P301+P330+P331, P303+P361+P353, P305+P351+P338, P308+P311 |
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с сильнокислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Токсична в больших дозах[4], обладает исключительно сильной коррозионной активностью.
Название
правитьВ XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах
Проверить информацию. |
Серную кислоту в то время называли «купоросным маслом»[5][6], очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Исторические сведения
правитьСерная кислота известна с древности, она встречается в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа(II) с последующим охлаждением смеси[7]
В трудах алхимика Василия Валентина (XVI век) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ применялся вплоть до 1955 г.
Алхимикам XV века в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешёвого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы(IV) в оксид серы(VI), и последующим растворением оксида серы(VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году в Звенигородском уезде Московской губернии. В 1913 году Российская империя по производству серной кислоты занимала 13-е место в мире.[8]
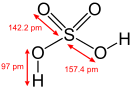
Физические и физико-химические свойства
правитьСерная кислота — это очень сильная двухосновная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3О+, HSO3+, и 2НSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
| H2SO4 | HSO4− | H3SO4+ | H3O+ | HS2O7⁻ | H2S2O7 | |
| состав, % | 99,5 | 0,18 | 0,14 | 0,09 | 0,05 | 0,04 |
Олеум
правитьРастворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, образующиеся по реакциям:
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 °C, г/см3 | Температура плавления, °C | Температура кипения, °C | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | - | 1,0661 | −5,5 | 102,0 |
| 20 | - | 1,1394 | −19,0 | 104,4 |
| 40 | - | 1,3028 | −65,2 | 113,9 |
| 60 | - | 1,4983 | −25,8 | 141,8 |
| 80 | - | 1,7272 | −3,0 | 210,2 |
| 98 | - | 1,8365 | 0,1 | 332,4 |
| 100 | - | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
Величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
В парах водных растворов серной кислоты при концентрации до 70% при нагревании не наблюдается сама серная кислота. При концентрации выше 70% количество серной кислоты в парах растёт экспоненциально. Так, при 80% концентрация H2SO4 в парах составляет около 5%, при 85% около 10% , при концентрации в 90% около 20%, но при 95% пар преимущественно представляет собой серную кислоту (все данные представлены в массовом отношении)[9].
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10−5 (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10−5T3/2 см2/с.
| ω, % | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,03 | 1,064 | 1,1365 | 1,215 | 1,2991 | 1,3911 | 1,494 | 1,6059 | 1,7221 | 1,7732 | 1,7818 | 1,7897 | 1,7968 | 1,8033 | 1,8091 | 1,8142 | 1,8188 | 1,8227 | 1,826 | 1,8286 | 1,8305 | 1,8314 | 1,831 | 1,8292 | 1,8255 |
Химические свойства
правитьСерная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
1. Окисляет HI и частично HBr до свободных галогенов:
- ΔH° = 18.14 кДж/моль (эндотермическая)[12] ΔS° = −14.95 Дж/моль (экзоэнтропическая)[12] ΔG° = 22.5 кДж/моль (эндергоническая)[12]
Углерод до CO2, серу — до SO2.
- Окисляет угарный газ до углекислого.
2. Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta). При этом концентрированная серная кислота восстанавливается до диоксида серы, например[13]:
3. На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются, и реакции не протекают.
4. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например[13]:
5. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
6. Серная кислота реагирует с гидроксидами и оксидами металлов, образуя сульфат металла и воду, а также некоторыми основаниями, образуя соль (например, аммиаком и гидразином):
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
7. Качественная реакция на серную кислоту и её растворимые соли — это их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например[14]:
8. Концентрированная серная кислота является очень сильным обезвоживающим агентом. Эти свойства используются в промышленности для осушения газов (кроме основных и восстановителей, например, аммиака и водорода), проведения чувствительных в воде реакций (например, реакций этерификации), а также применяется в эксикаторах. Она способна отнимать воду у химических соединений, иногда, разрушая их. Данный процесс обусловлен тем, что серная кислота образует с водой гидраты H2SO4·nH2O (n = 1-4, 6, 8), при этом в данная реакция сильно экзотермична. При смешивании кислоты и воды смесь может вскипеть, потому, при разбавлении серной кислоты рекомендуется аккуратно вливать кислоту в воду (не наоборот), перемешивая её.
Может отнимать воду у кристаллогидратов, например, синий пентагидрат сульфата меди(II) обесцвечивается ввиду потери кристаллизационной воды, которая связывается серной кислотой:
Углеводы при контакте с концентрированной серной кислотой обугливаются. Например, сахароза разлагается концентрированной серной кислотой до углерода и воды, что сопровождается чернением смеси и увеличением объёма смеси ввиду выделения пара (реакция часто сопровождается большим выделением тепла, что и вызывает испарение воды):
Также, серная кислота способна обезвоживать древесину, обугливая её. При комнатной температуре серная кислота способна обугливать древесину при концентрациях свыше 70-75% масс.
Концентрированная серная кислота способна разрушать многие органические вещества таким образом, потому, со временем она может темнеть при хранении в пластиковой таре и при попадании туда пыли. Для осветления коричневой и чёрной серной кислоты, к ней добавляют небольшое количество пероксида водорода. В зависимости от степени загрязнения, от 0,01% до 0,03% раствора с концентрацией 30%. После перемешивания, она становится жёлтой или светло-жёлтой. Добавление избыточного количества пероксида водорода чревато образованием пероксомоносерной кислоты, которая может быть разрушена сернистым газом[15] При нагревании можно достичь полного обесцвечивания кислоты (при условии отсуствия иных окрашивающих примесей, например, солей).
9. Серная кислота, являясь сильной кислотой, протонирует другие вещества. Например, в воде она диссоциирует в две ступени. По первой как сильная кислота, а по второй - как кислота средней силы, что обусловлено слабыми кислотными свойствами гидросульфат иона.
- , pKa = -3
- , pKa = 1,92
Ввиду этого, серная кислота реагирует со своими средними солями, образуя кислые соли:
Также, безводная серная кислота при смешивании с безводной азотной кислотой, протонирует её, образуя сильный нитрующий агент нитроний — NO2+:
Равновесие при использовании безводных кислот практически полностью смещено вправо. Вода смещает равновесие влево, вплоть до некоторых концентраций, серная кислота способа связать её. Такую смесь иногда называют меланж.
10. Серная кислота часто применятся как кислотный катализатор и подкислитель в некоторых реакциях. Разбавленная серная кислота не является окислителем и склонна проявлять свойства обычной кислоты. Например, в растворе серной кислоты можно гидролизовать сахарозу до фруктозы и глюкозы. Серную кислоту часто используют в смеси с перманганатом калия для создания кислой среды, в которой перманганат ион обладает высшими окислительными свойствами и в смеси с дихроматом калия для создания так называемой хромовой смеси, которая способна разрушать многие загрязнения.
11. Концентрированная серная кислота может вытеснять даже сильные кислоты из их солей (однако для полноты реакции рекомендуется нагрев). Например, хлороводород, азотную кислоту, марганцовую кислоту (нестабильна, может разложиться до оксида марганца(VII)). При этом если кислота сильнее гидросульфат иона, то образовываться будут гидросульфаты, например:
Если кислота стабильна термически, получающийся гидросульфат при очень высокой температуре (несколько сотен градусов Цельсия и выше) вновь реагирует с исходной солью, вытесняя из неё кислоту:
Общая реакция будет выглядеть так:
Слабые кислоты способна вытеснять полностью без нагревания:
Получение серной кислоты
правитьПромышленный (контактный) способ
правитьВ промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания элементарной серы, серного колчедана или сероводород-содержащих газов, поступающих с установок гидроочистки и систем отпарки кислых стоков) до триоксида (серного ангидрида) на твёрдом ванадиевом катализаторе в четыре ступени (данная реакция экзотермична, поэтому применяется промежуточное охлаждение после первого слоя с помощью трубных пучков, через которые подаётся воздух, и после следующих двух ступеней — с помощью кольцевой трубы, имеющей большой диаметр, через которую подаётся воздух, над которой расположен дефлектор. Воздух нагнетается воздуходувками, часть горячего воздуха подаётся на горелочные устройства котлов, в которых производится сжигание сероводородсодержащих газов) последующим охлаждением и взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют «контактной» (концентрация 92-94 %).
Нитрозный (башенный) способ
правитьРаньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли «башенной» (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Нетто реакция:
Лабораторные методы
правитьВ лаборатории можно получить серную кислоту взаимодействием сероводорода, элементарной серы и диоксида серы с хлорной или бромной водой или пероксидом водорода с дальнейшим концентрированием продукта осторожным выпариванием без кипения:
Также её можно получить взаимодействием диоксида серы с кислородом и водой при +70 °C под давлением в присутствии сульфата меди(II):
Или электролизом растворов сульфатов металлов, стоящих в ряду напряжений после водорода (для максимизации выхода):
Помимо этого, возможно получение серной кислоты термическим разложением сульфатов переходных металлов или пиросульфатов натрия или калия с выделением серного ангидрида, который впоследствии растворяют в воде. Сульфаты щелочных металлов устойчивы термически, однако гидросульфаты разлагаются с выделением воды и переходят в пиросульфаты:
Из-за того, что разница температур, при которых происходит пиролиз гидросульфатов и пиросульфатов относительна велика, возможно отогнать воду из первых, а последние разложить до SO3:
Разложение сульфатов переходных металлов часто записывают до SO2 и O2, что, однако, не всегда верно, ибо SO3 выделяется, однако оксиды переходных металлов катализируют его разложение до SO2 и O2, однако примесь SO3 так или иначе будет присутствовать в газовой фазе. Однако сульфат железа(III) способен выделять значительное количество SO3 при пиролизе:
Применение
правитьСерную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- в качестве электролита в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанола из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год[16]. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P2O5 фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH4)2SO4 серной кислоты 75 % от массы расходуемого (NH4)2SO4. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
правитьСерная кислота и олеум — очень едкие вещества, поражающие все ткани организма. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Попадание кислоты на глаза в высокой концентрации может привести как к конъюнктивиту, так и к полной потере зрения[17].
Предельно допустимая концентрация (ПДК) паров серной кислоты в воздухе рабочей зоны 1 мг/м3, в атмосферном воздухе 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин).
Серная кислота — токсичное вещество. В соответствии с ГОСТ 12.1.007-76 серная кислота является токсичным высокоопасным веществом[18] по воздействию на организм, 2-го класса опасности.
Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды серы и выпадать в виде кислотных дождей.
С 1980-х годов в странах Южной и Юго-Восточной Азии распространилась практика обливания кислотой. Столкновение традиционной морали, религиозных норм и изменяющегося современного быта привело к многочисленным случаям нападений из ревности (более 200 эпизодов в Бангладеш в 1999 году[19]). Мотивом такого преступления чаще всего служит месть за отвержение женщиной или за несогласие выйти замуж. Несмотря на введение смертной казни и длительных сроков заключения за обливание кислотой, проблема является острой в Бангладеш, Индии, Шри-Ланке, Пакистане, а также в Мьянме, Лаосе и Камбодже[20][21].
Особенно опасно обливание кислотой для живописи и произведений искусства. В разное время пострадали «Даная» Рембрандта (Эрмитаж, Санкт-Петербург, 1985), триптих Дюрера «Алтарь Паумгартнеров» (Старая пинакотека, Мюнхен, 1988) и другие картины. Реставрация требует многих лет работы и сопряжена с невосполнимыми потерями.
В Российской Федерации и Республике Казахстан оборот серной кислоты концентрации 45 % и более — законодательно ограничен[22][23].
Дополнительные сведения
правитьМельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[24]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994[25].
Стандарты
править- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания
править- ↑ Кислота серная техническая ГОСТ 2184—77
- ↑ Encyclopedia of chemical technology (англ.) / R. E. Kirk, D. Othmer
- ↑ http://www.cdc.gov/niosh/npg/npgd0577.html
- ↑ name=https://docs.cntd.ru_Серная кислота
- ↑ Ушакова Н. Н., Фигурновский Н. А. Василий Михайлович Севергин: (1765—1826) / Ред. И. И. Шафрановский. М.: Наука, 1981. C. 59.
- ↑ См. также Каменное масло
- ↑ Эпштейн, 1979, с. 40.
- ↑ Эпштейн, 1979, с. 41.
- ↑ Sulfuric Acid Treatment | De Dietrich Process Systems. www.dedietrich.com. Дата обращения: 1 октября 2023. Архивировано 11 октября 2023 года.
- ↑ Density-Concentration Calculator (англ.). Дата обращения: 21 декабря 2021. Архивировано 21 декабря 2021 года.
- ↑ 1 2 sulfuric acid hydrogen iodide -> iodine H2S water - Wolfram|Alpha (англ.). www.wolframalpha.com. Дата обращения: 19 мая 2022. Архивировано 19 мая 2022 года.
- ↑ 1 2 3 sulfuric acid hydrogen bromide -> bromine sulfur dioxide water - Wolfram|Alpha (англ.). www.wolframalpha.com. Дата обращения: 19 мая 2022. Архивировано 19 мая 2022 года.
- ↑ 1 2 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 91. Химические свойства серной кислоты // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 209—211. — 240 с. — 1 630 000 экз.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Карякин Ю. В. Чистые химические вещества. — С. 186.
- ↑ Sulfuric acid Архивная копия от 26 мая 2017 на Wayback Machine (англ.) // «The Essential Chemical Industry — online»
- ↑ SULFURIC ACID | CAMEO Chemicals | NOAA. cameochemicals.noaa.gov. Дата обращения: 22 мая 2020. Архивировано 20 октября 2020 года.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. ССБТ. Вредные вещества. Классификация и общие требования
- ↑ "CNN.com - Bangladesh combats an acid onslaught against women - November 11, 2000". Архивировано из оригинала 22 сентября 2007. Дата обращения: 13 марта 2008.
- ↑ Various. Combating acid violence in Bangladesh, India, and Cambodia (англ.). — New York: Avon Global Center for Women and Justice at Cornell Law School[англ.], Committee on International Human Rights of the, New York City Bar Association[англ.], Cornell Law School International Human Rights Clinic[англ.] and the Virtue Foundation. Архивировано 18 апреля 2018 года.
- ↑ Harris, Rob. "Acid Attacks". The New York Times. Архивировано 31 марта 2012. Дата обращения: 8 марта 2018.
- ↑ Постановление Правительства Российской Федерации от 3 июня 2010 года № 398. Дата обращения: 30 мая 2016. Архивировано из оригинала 30 июня 2016 года.
- ↑ Об утверждении Списка наркотических средств, психотропных веществ и прекурсоров, подлежащих контролю в Республике Казахстан, Сводной таблицы об отнесении наркотических средств, психотропных веществ, их аналогов и прекурсоров, обнаруженных в незаконном обороте, к небольшим, крупным и особо крупным размерам, Списка заместителей атомов водорода, галогенов и (или) гидроксильных групп в структурных формулах наркотических средств, психотропных веществ - ИПС "Әділет". adilet.zan.kz. Дата обращения: 1 октября 2023. Архивировано 3 июня 2023 года.
- ↑ см. статью «Вулканы и климат» Архивная копия от 28 сентября 2007 на Wayback Machine (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? Архивная копия от 1 декабря 2007 на Wayback Machine (рус.)
Литература
править- Справочник сернокислотчика [Текст] / А. С. Ленский, П. А. Семенов, Г. А. Максудов; ред. К. М. Малин. — 2 изд., перераб. и доп. — М.: Химия, 1971. — 744 с. — Библиогр. в конце разд.- Предм. указ.: с. 723—744.
- Эпштейн Д. А. Общая химическая технология. — М.: Химия, 1979. — 312 с.