Боровская модель атома
Бо́ровская моде́ль а́тома (моде́ль Бо́ра, моде́ль Бо́ра — Резерфо́рда) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Эрнестом Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают энергию, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения (момент импульса) электрона равен целому числу постоянных Планка[2]: .
В истории атомной физики она следовала и в конечном итоге заменила несколько более ранних моделей, включая модель Солнечной системы Джозефа Лармора предложенной в 1897 году, модель Жана Перрена от 1901 года[3], кубическую модель — в 1902 году предложенной Хантаро. Модель Сатурна Нагаоки от 1904 года, модель сливового пудинга (1904 год), квантовая модель Артура Гааза (1910 год), модель Резерфорда (1911 год) и ядерная квантовая модель Джона Уильяма Николсона (1912 года). Улучшение модели Резерфорда 1911 года в основном касалось новой квантово-механической интерпретации, предложенной Хаасом и Николсоном, но без каких-либо попыток объяснить излучение с помощью классической физики.
Ключевой успех модели заключается в объяснении формулы Ридберга для спектральных линий излучения водорода. Хотя формула Ридберга была известна экспериментально, она не получила теоретического обоснования до тех пор, пока не была представлена модель Бора. Модель Бора не только объяснила причины структуры формулы Ридберга, но и дала обоснование фундаментальным физическим константам, которые составляют эмпирические результаты формулы.
Радиус первой орбиты в атоме водорода R0=5,2917720859(36)⋅10−11 м[4], ныне называется боровским радиусом, либо атомной единицей длины и широко используется в современной физике. Энергия первой орбиты эВ представляет собой энергию ионизации атома водорода.
Модель Бора является относительно примитивной моделью атома водорода по сравнению с моделью валентной оболочки. Как теория, она может быть выведена как приближение первого порядка атома водорода с использованием более широкой и гораздо более точной квантовой механики и, таким образом, может считаться устаревшей научной теорией. Однако из-за своей простоты и правильных результатов для выбранных систем (применение см. ниже) модель Бора по-прежнему обычно преподается для ознакомления студентов с квантовой механикой или диаграммами энергетических уровней, прежде чем переходить к более точной, но и более сложной модели валентных оболочек атома. Соответствующая квантовая модель была предложена Артуром Эрихом Гаазом в 1910 году, но была отвергнута до Сольвеевского конгресса 1911 года, где она тщательно обсуждалась[5]. Квантовую теорию периода между открытием Планком кванта в 1900 году и появлением зрелой квантовой механики 1925 года часто называют старой квантовой теорией.
Предыстория
правитьВ начале 20 века эксперименты Эрнеста Резерфорда установили, что атомы состоят из облака отрицательно заряженных электронов, окружающего небольшое плотное положительно заряженное ядро[7]. Учитывая эти экспериментальные данные, Резерфорд в 1911 рассмотрел планетарную модель атома — модель Резерфорда. Это привело к тому, что электроны вращались вокруг ядра, но возникла техническая трудность: законы классической механики (то есть формула Лармора) предсказывают, что электрон будет испускать электромагнитное излучение, вращаясь вокруг ядра. Поскольку электрон потеряет энергию, он будет быстро вращаться по спирали внутрь, коллапсируя в ядро примерно за 16 пикосекунд[8]. Модель атома Резерфорда катастрофична, поскольку она предсказывает, что все атомы нестабильны[9]. Кроме того, по мере того, как электрон движется по спирали внутрь, частота излучения будет быстро увеличиваться из-за сокращения орбитального периода, что приведёт к электромагнитному излучению с непрерывным спектром. Однако эксперименты конца XIX века с электрическими разрядами показали, что атомы излучают свет (то есть электромагнитное излучение) только на определённых дискретных частотах. К началу двадцатого века ожидалось, что свойства атомов отвечают за спектральные линии. В 1897 году лорд Рэлей проанализировал эту проблему. К 1906 году Рэлей сказал: «Частоты, наблюдаемые в спектре, могут вообще не быть частотами возмущений или колебаний в обычном смысле этого слова, а скорее составлять существенную часть первоначального строения атома, определяемого условиями стабильности»[10][11].
Схема атома Бора появилась во время работы первой Сольвеевской конференции в 1911 году в отделении с темой «Излучение и кванты», на которой присутствовал наставник Бора, Резерфорд. Лекция Макса Планка завершилась таким замечанием: «…атомы или электроны, находящиеся в молекулярной связи, подчинялись бы законам квантовой теории»[12][13]. Хендрик Лоренц при обсуждении лекции Планка поднял вопрос о составе атома на основе модели Томсона, причём большая часть дискуссии вращалась вокруг модели атома, разработанной Артуром Эрихом Гаазом. Лоренц объяснил, что постоянную Планка можно использовать для определения размера атомов или что размер атомов можно использовать для определения постоянной Планка[14]. Лоренц включил комментарии относительно испускания и поглощения излучения, заключив, что «будет установлено стационарное состояние, в котором количество электронов, входящих в их сферы, будет равно числу покинувших их»[5]. При обсуждении того, что может регулировать разницу в энергии между атомами, Макс Планк просто заявил: «Посредниками могут быть электроны»[15]. В ходе дискуссий обозначилась необходимость включения квантовой теории в атом и трудности атомной теории. Планк в своём выступлении прямо сказал: «Чтобы осциллятор [молекула или атом] мог обеспечить излучение в соответствии с уравнением, необходимо ввести в законы его работы, как мы уже говорили в начале настоящего Отчета, это особая физическая гипотеза, которая по фундаментальному вопросу явно или молчаливо противоречит классической механике»[16]. В первой статье Бора о его модели атома почти слово в слово цитируется Планк, говорящий: «Какими бы ни были изменения в законах движения электронов, представляется необходимым ввести в рассматриваемые законы величину, чуждую классической электродинамика, то есть постоянная Планка или, как её часто называют, элементарный квант действия». Сноска Бора внизу страницы относится к французскому переводу Сольвеевского конгресса 1911 года, доказывая, что он построил свою модель непосредственно на основе процедур и фундаментальных принципов, изложенных Планком, Лоренцем и квантовой моделью атома Артура Гааза, о которой упоминалось семнадцать раз[7]. Лоренц завершил обсуждение выступления Эйнштейна, объяснив: "Предположение, что эта энергия должна быть кратна приводит к следующей формуле, где является целым числом: [17]. Резерфорд мог бы изложить эти положения Бору или дать ему копию материалов, поскольку он цитировал и ссылался на них[18]. В более позднем интервью Бор сказал, что ему было очень интересно услышать замечания Резерфорда о Сольвеевском конгрессе[19]. Но Бор сказал: «Я видел настоящие отчёты» Сольвеевского конгресса[20].
Затем, в 1912 году, Бор наткнулся на теорию модели атома Джона Уильяма Николсона, которая квантовала угловой момент как . Согласно статье в журнале Nature, посвящённой празднованию столетия атома Бора, именно Николсон обнаружил, что электроны излучают спектральные линии, когда они нисходят к ядру, и его теория была одновременно ядерной и квантовой[13][21][22]. Нильс Бор процитировал его в своей статье 1913 года о модели атома Бора[7]. Важность работы ядерной квантовой атомной модели Николсона над моделью Бора подчеркивалась многими историками[22][23][24][25].
Затем его друг Ханс Хансен сообщил Бору, что ряд Бальмера рассчитывается с использованием формулы Бальмера — эмпирического уравнения, открытого Иоганном Бальмером в 1885 году и описывающего длины волн некоторых спектральных линий водорода[19]. Это было далее обобщено Йоханнесом Ридбергом в 1888 году, что привело к тому, что сейчас известно как формула Ридберга. После этого, заявил Бор, «все стало ясно»[26].
Для преодоления трудностей атома Резерфорда, в 1913 году Нильс Бор выдвинул три постулата, которые резюмируют большую часть его модели:
- Электрон способен вращаться по определённым стабильным орбитам вокруг ядра, не излучая никакой энергии, вопреки выводам классического электромагнетизма. Эти стабильные орбиты называются стационарными орбитами и достигаются на определённых дискретных расстояниях от ядра. Электрон не может обладать никакими другими орбитами, расположенными между дискретными.
- Стационарные орбиты достигаются на расстояниях, на которых угловой момент вращающегося электрона является целым кратным приведённой постоянной Планка: , где называется главным квантовым числом, а . Самая низкое значение равено 1; это даёт наименьший возможный радиус орбиты, известный как радиус Бора, равный 0,0529 нм для атома водорода. Когда электрон оказывается на этой нижней орбите, он не может приблизиться к ядру. Отталкиваясь от квантового правила углового момента, которое, как признает Бор, ранее было дано Николсоном в его статье 1912 года[13][19][21][22], Бор[7] смог вычислить энергии разрешённых орбит атома водорода и других водородоподобных атомов и ионов. Эти орбиты связаны с определёнными энергиями и называются также энергетическими оболочками или энергетическими уровнями. На этих орбитах ускорение электрона не приводит к излучению и потерям энергии. Модель атома Бора была основана на квантовой теории излучения Планка.
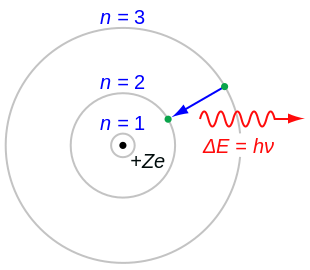
- Электроны могут приобретать и терять энергию, только перепрыгивая с одной разрешённой орбиты на другую, поглощая или излучая электромагнитное излучение с частотой определяемой разностью энергий уровней согласно соотношению Планка: , где — постоянная Планка.
Другие моменты:
- Как и теория фотоэлектрического эффекта Эйнштейна, формула Бора предполагает, что во время квантового скачка излучается дискретное количество энергии. Однако, в отличие от Эйнштейна, Бор придерживался классической теории электромагнитного поля Максвелла. Квантование электромагнитного поля объяснялось дискретностью энергетических уровней атома; Бор не верил в существование фотонов[27][28].
- Согласно теории Максвелла частота классического излучения равна частоте вращения вращение электрона на его орбите с гармониками, кратными этой частоте. Этот результат получен из модели Бора для скачков между уровнями энергий и , когда намного меньше, чем . Эти скачки воспроизводят частоту -й гармоники орбиты с главным квантовым числом . При достаточно больших значениях (так называемые состояния Ридберга), две орбиты, участвующие в процессе излучения, имеют почти одинаковую частоту вращения, так что классическая орбитальная частота не является двусмысленной. Но для малых значений (или большой ), частота излучения не имеет однозначной классической интерпретации. Это знаменует собой рождение принципа соответствия, требующего, чтобы квантовая теория согласовывалась с классической теорией только в пределе больших квантовых чисел.
- Теория Бора — Крамерса — Слейтера (теория БКС) представляет собой неудачную попытку расширить модель Бора, которая нарушает закон сохранения энергии и импульса в квантовых скачках, при этом законы сохранения выполняются только в среднем.
Условие Бора, согласно которому угловой момент должен быть целым кратным , позже было интерпретировано в 1924 году де Бройлем как состояние стоячей волны: электрон описывается волной, и вдоль окружности орбиты электрона должно умещаться целое число длин волн:
Согласно гипотезе де Бройля, частицы материи, такие как электрон, ведут себя как волны. Длина волны де Бройля электрона равна
что подразумевает, что
или
где — угловой механический момент вращающегося электрона. Принисвя для этого углового момента предыдущее уравнение принимает вид
что является вторым постулатом Бора.
Бор описал угловой момент орбиты электрона как в то время как длина волны де Бройля описал разделённое на импульс электрона. Однако в 1913 году Бор оправдал свое правило, апеллируя к принципу соответствия, не предлагая никакой волновой интерпретации. В 1913 году о волновом поведении частиц материи, таких как электрон, не подозревали.
В 1925 году был предложен новый вид механики — квантовая механика, в которой модель Бора электронов, движущихся по квантованным орбитам, была расширена до более точной модели движения электронов. Новую теорию предложил Вернер Гейзенберг. Другая форма той же теории, волновая механика, была открыта австрийским физиком Эрвином Шрёдингером независимо и на основе других рассуждений. Шрёдингер использовал волны материи де Бройля, но искал волновые решения трёхмерного волнового уравнения, описывающего электроны, которые были вынуждены двигаться вокруг ядра водородоподобного атома, будучи захваченными потенциалом положительного заряда ядра.
Уровни энергии электронов
правитьМодель Бора даёт почти точные результаты только для системы, в которой две заряженные точки вращаются вокруг друг друга со скоростью, намного меньшей скорости света. Это касается не только одноэлектронных систем, таких как атом водорода, однократно ионизированного гелия и дважды ионизированного лития, но также включает позитрониевые и ридберговские состояния любого атома, где один электрон находится далеко от всего остова. Его можно использовать для расчётов рентгеновского перехода K-линии, если добавить другие предположения (см. Закон Мозли ниже). В физике высоких энергий его можно использовать для расчёта масс тяжёлых кварковых мезонов.
Расчёт орбит требует двух предположений.
- Классическая механика
- Электрон удерживается на круговой орбите за счёт электростатического притяжения. Центростремительная сила равна кулоновской силе.
- где me — масса электрона, e — элементарный заряд, ke — постоянная Кулона, а Z — атомный номер атома. Здесь предполагается, что масса ядра намного больше массы электрона (что является хорошим предположением). Это уравнение определяет скорость электрона на любом радиусе:
- Оно также определяет полную энергию электрона на любом радиусе:
- Полная энергия отрицательна и обратно пропорциональна r. Это означает, что требуется энергия, чтобы оторвать вращающийся электрон от протона. При бесконечных значениях r энергия равна нулю, что соответствует неподвижному электрону, бесконечно далёкому от протона. Полная энергия равна половине потенциальной энергии, а разница составляет кинетическую энергию электрона. Это также верно для некруговых орбит по теореме вириала.
- Квантовое правило
- Угловой момент L = mevr является целым кратным ħ
Вывод
правитьЕсли электрон в атоме движется по орбите с периодом T, то классически электромагнитное излучение будет повторяться каждый орбитальный период. Если связь с электромагнитным полем слабая, так что орбита не сильно затухает за один цикл, излучение будет излучаться по схеме, повторяющейся каждый период, так что преобразование Фурье будет иметь частоты, кратные лишь 1/Т. Однако в квантовой картине квантование углового момента приводит к дискретным уровням энергии, а излучаемые частоты квантуются в соответствии с разницей энергий между этими уровнями. Эта дискретная природа энергетических уровней вносит фундаментальное отклонение от классического закона излучения, приводя к появлению различных спектральных линий в испускаемом излучении.
В квантовой механике это излучение должно происходить квантами света с частотами, состоящими из целых чисел, кратных 1/T, так что классическая механика представляет собой приближённое описание при больших квантовых числах. Это означает, что уровень энергии, соответствующий классической орбите периода 1/T, должен иметь близлежащие энергетические уровни, отличающиеся по энергии на величину h/T, и они должны быть расположены на одинаковом расстоянии от этого уровня,
Бор беспокоился, следует ли рассчитывать энергетическое расстояние 1/T с учётом периода энергетического состояния , или или какого-то среднего значения — оглядываясь назад, можно сказать, что эта модель является лишь ведущим полуклассическим приближением.
Бор рассматривал круговые орбиты. Классически эти орбиты должны распадаться на круги меньшего размера при испускании фотонов. Расстояние между уровнями между круговыми орбитами можно рассчитать из принципа соответствия. Для атома водорода классические орбиты имеют период T, определяемый третьим законом Кеплера и масштабируемый как r3/2. Энергия масштабируется как 1/r, поэтому формула расстояния между уровнями равна
Можно определить уровни энергии, методом рекурсии спускаясь с орбиты за орбитой, но есть короткий путь.
Угловой момент L круговой орбиты масштабируется как . Тогда энергия, выраженная через угловой момент, равна
Предполагая вслед за Бором, что квантованные значения L расположены на одинаковом расстоянии друг от друга, расстояние между соседними энергиями равно
Это справедливо для равноотстоящих друг от друга угловых моментов. Если следить за константами, то расстояние было бы ħ, поэтому угловой момент должен быть целым числом, кратным ħ,
Так Бор пришёл к своей модели.
- Подстановка выражения для скорости даёт уравнение для r через n:
- так что разрешённый радиус орбиты при любом n равен
- Наименьшее возможная величина r в атоме водорода (Z = 1) называется радиусом Бора и равно:
- Энергия n-го уровня для любого атома определяется радиусом и главным квантовым числом:
Следовательно, электрон на самом низком энергетическом уровне водорода при n = 1 имеет на около 13,6 эВ меньше энергии, чем у неподвижного электрона, находящегося бесконечно далеко от ядра. Следующий уровень энергии при n = 2 равен −3,4 эВ. Третий (n = 3) равен −1,51 эВ и так далее. Для больших значений n это также энергии связи высоковозбуждённого атома с одним электроном, находящимся на круговой орбите большого радиуса. Формула водорода также совпадает с произведением Уоллиса[29].
Совокупность натуральных констант в формуле энергии называется энергией Ридберга (RE):
Это выражение уточняется путём толкования его в сочетаниях, образующих более естественные единицы:
- — энергия покоя электрона (511 кэВ),
- — константа тонкой структуры ,
- .
Поскольку этот вывод основан на предположении, что вокруг ядра вращается один электрон, мы можем обобщить этот результат, предположив, что ядро имеет заряд q = Ze, где Z — атомный номер. Теперь это даст нам уровни энергии для водородоподобных атомов, которые могут служить грубым приближением порядка величины реальных энергетических уровней. Итак, для ядер с Z протонов уровни энергии таковы (в грубом приближении):
Фактические уровни энергии не могут быть найдены аналитически более чем для одного электрона (см. задачу n -тел), поскольку электроны не только подвергаются воздействию ядра, но также взаимодействуют друг с другом посредством кулоновской силы.
Когда Z = 1/ α (Z ≈ 137), движение становится сильно релятивистским, и Z2 компенсирует α2 в R; энергия орбиты становится сравнимой с энергией покоя. Достаточно большие ядра, если бы они были стабильными, уменьшили бы свой заряд, создав связанный электрон из вакуума, выбрасывая позитрон на бесконечность. Это теоретическое явление экранирования электромагнитного заряда, которое предсказывает максимальный заряд ядра. Эмиссия таких позитронов наблюдалась при столкновениях тяжелых ионов с образованием короткоживущих сверхтяжёлых ядер[30].
В формуле Бора во всех ситуациях правильно используется приведённая масса электрона и протона вместо массы электрона.
Однако эти числа почти одинаковы из-за гораздо большей массы протона, примерно в 1836,1 раза превышающей массу электрона, так что приведённая масса в системе равна массе электрона, умноженной на константу 1836,1/(1+1836,1) = 0,99946. Этот факт имел исторически важное значение для убеждения Резерфорда в важности модели Бора, поскольку он объяснял тот факт, что частоты линий в спектрах однократно ионизованного гелия отличаются от частот линий водорода не ровно в 4 раза, а, скорее, в 4 умножденной на соотношение приведенной массы водородной и гелиевой систем, что было намного ближе к экспериментальному соотношению, чем ровно 4.
Для позитрония в формуле также используется приведённая масса, но в данном случае это именно масса электрона, делённая на 2. При любом значении радиуса электрон и позитрон движутся каждый с половиной скорости вокруг своего общего центра масс, и каждый обладает только одной четвертью кинетической энергии. Полная кинетическая энергия вдвое меньше, чем у одного электрона, движущегося вокруг тяжёлого ядра.
- (позитроний).
Формула Ридберга
правитьФормула Ридберга, которая была известна эмпирически до формулы Бора, рассматривается в теории Бора как описывающая энергии переходов или квантовых скачков между орбитальными уровнями энергии. Формула Бора даёт численное значение уже известной и измеренной постоянной Ридберга, но в терминах более фундаментальных констант природы, включая заряд электрона и постоянную Планка.
Когда электрон перемещается со своего исходного энергетического уровня на более высокий, он затем прыгает обратно перемещаясь по нидележашим уровеням, пока не достигнет исходного положения, что приводит к испусканию фотона. Используя полученную формулу для различных энергетических уровней водорода, можно определить длины волн света, которые может излучать атом водорода.
Энергия фотона, испускаемого атомом водорода, определяется разностью двух энергетических уровней водорода:
где nf — главное квантовое чило для конечного уровеня энергии, а ni — для начального уровеня энергии.
Поскольку энергия фотона
длина волны испускаемого фотона определяется выражением
Это известно как формула Ридберга, а константа Ридберга R равна RE/hc или RE/2π в натуральных единицах. Эта формула была известна в девятнадцатом веке учёным, изучавшим спектроскопию, но до Бора не было теоретического объяснения этой формы или теоретического предсказания значения R. Фактически вывод Бором постоянной Ридберга, а также сопутствующее ему согласие формулы Бора с экспериментально наблюдаемыми спектральными линиями Лаймана (nf =1), Бальмера (nf =2) и Пашена (nf =3) серий и успешное теоретическое предсказание других, ещё не наблюдавшихся линий, стали одной из причин того, что его модель была немедленно принята.
Чтобы применить формулу Ридберга к атомам с более чем одним электроном, её можно изменить, заменив Z на Z − b или n с n − b, где b — константа, представляющая эффект экранирования, вызванный внутренней оболочкой и другими электронами (см. «Электронная оболочка» и более позднее обсуждение «Модели оболочки атома» ниже). Это было установлено эмпирически ещё до того, как Бор представил свою модель.
Модель оболочки (более тяжёлые атомы)
правитьПервые три статьи Бора 1913 года описывали главным образом электронную конфигурацию в более лёгких элементах. В 1913 году Бор назвал свои электронные оболочки «кольцами». Во времена его планетарной модели атомных орбиталей внутри оболочек не существовало. Бор объясняет в части 3 своей знаменитой статьи 1913 года, что максимальное количество электронов в оболочке равно восьми, написав: «Мы видим далее, что кольцо из n электронов не может вращаться в одном кольце вокруг ядра с зарядом ne , если только n < 8.» Для меньших атомов электронные оболочки будут заполнены следующим образом: «кольца электронов соединятся вместе только в том случае, если они содержат одинаковое количество электронов; и что, соответственно, число электронов на внутренних кольцах будет только 2, 4, 8». Однако в атомах с большим числом электронов самая внутренняя оболочка будет содержать восемь электронов, «с другой стороны, периодическая система элементов убедительно предполагает, что уже в неоне N = 10 возникнет внутреннее кольцо из восьми электронов». Бор писал: "Из вышеизложенного мы приходим к следующей возможной схеме расположения электронов в лёгких атомах: "[6][18][31][32]
| Элемент | Электроны на оболочку | Элемент | Электроны на оболочку | Элемент | Электроны на оболочку |
|---|---|---|---|---|---|
| 1 | 1 | 9 | 4, 4, 1 | 17 | 8, 4, 4, 1 |
| 2 | 2 | 10 | 8, 2 | 18 | 8, 8, 2 |
| 3 | 2, 1 | 11 | 8, 2, 1 | 19 | 8, 8, 2, 1 |
| 4 | 2, 2 | 12 | 8, 2, 2 | 20 | 8, 8, 2, 2 |
| 5 | 2, 3 | 13 | 8, 2, 3 | 21 | 8, 8, 2, 3 |
| 6 | 2, 4 | 14 | 8, 2, 4 | 22 | 8, 8, 2, 4 |
| 7 | 4, 3 | 15 | 8, 4, 3 | 23 | 8, 8, 4, 3 |
| 8 | 4, 2, 2 | 16 | 8, 4, 2, 2 | 24 | 8, 8, 4, 2, 2 |
В третьей статье Бора 1913 года, часть III, под названием «Системы, содержащие несколько ядер», он говорит, что два атома образуют молекулы в симметричной плоскости, и возвращается к описанию водорода[33]. Модель Бора 1913 года не рассматривала подробно тяжёлые элементы, и Джон Уильям Николсон был одним из первых, кто доказал в 1914 году, что она не работает для лития, но представляет собой привлекательную теорию для водорода и ионизированного гелия[18][34].
В 1921 году, следуя за работами химиков и других специалистов, занимавшихся работой над таблицей Менделеева, Бор расширил модель водорода, чтобы дать приближённую модель для более тяжёлых атомов. Это дало физическую картину, которая впервые воспроизвела многие известные атомные свойства, хотя эти свойства были предложены одновременно с идентичной работой химика Чарльза Раджли Бери[6][35].
Партнёром Бора по исследованиям в период с 1914 по 1916 год был Вальтер Коссель, который исправил работу Бора и показал, что электроны взаимодействуют через внешние кольца, а Коссель назвал кольца «оболочками»[36][37]. Ирвингу Ленгмюру приписывают первое жизнеспособное расположение электронов в оболочках: всего два в первой оболочке и до восьми в следующей в соответствии с правилом октетов 1904 года, хотя Коссель уже предсказал максимум восемь на оболочку в 1916 году[38]. Более тяжёлые атомы имеют больше протонов в ядре и больше электронов, которые нейтрализуют заряд. Бор позаимствовал у этих химиков идею о том, что каждая дискретная орбита может удерживать только определённое количество электронов. По мнению Косселя, после того, как орбита заполнится, необходимо будет использовать следующий уровень[6]. Это даёт атому оболочечную структуру, разработанную Косселем, Ленгмюром и Бери, в которой каждая оболочка соответствует орбите Бора.
Эта модель даже более приблизительна, чем модель водорода, поскольку она рассматривает электроны в каждой оболочке как невзаимодействующие. Но отталкивание электронов в некоторой степени учитывается явлением экранирования. Электроны на внешних орбитах не только вращаются вокруг ядра, но и вокруг внутренних электронов, поэтому эффективный заряд Z, который они ощущают, уменьшается на количество электронов на внутренней орбите.
Например, атом лития имеет два электрона на самой нижней 1s-орбите, и они вращаются по орбите Z = 2. Каждый видит ядерный заряд Z = 3 минус экранирующий эффект другого, грубо уменьшающий ядерный заряд на 1 единицу. Это означает, что самые внутренние электроны вращаются примерно на 1/2 радиуса Бора. Самый внешний электрон лития вращается примерно по радиусу Бора, поскольку два внутренних электрона уменьшают заряд ядра на 2. Этот внешний электрон должен находиться на расстоянии почти одного боровского радиуса от ядра. Поскольку электроны сильно отталкивают друг друга, описание эффективного заряда очень приблизительное; эффективный заряд Z обычно не является целым числом.
Оболочечная модель смогла качественно объяснить многие загадочные свойства атомов, которые в конце 19 века были систематизированы в периодической таблице элементов. Одним из свойств был размер атомов, который можно было приблизительно определить, измеряя вязкость газов и плотность чистых кристаллических твёрдых тел. Размеры атомов имеют тенденцию уменьшаться вправо в таблице Менделеева и становиться намного больше на следующей строке таблицы. Атомы справа от таблицы имеют тенденцию приобретать электроны, а атомы слева — терять их. Каждый элемент в последнем столбце таблицы химически инертен (благородный газ).
В оболочечной модели это явление объясняется заполнением оболочки. Последующие атомы становятся меньше, потому что они заполняют орбиты одинакового размера, пока орбита не заполнится, после чего у следующего атома в таблице будет слабосвязанный внешний электрон, что заставит его расширяться. Первая орбита Бора заполняется, когда на ней имеется два электрона, что объясняет, почему гелий инертен. Вторая орбита допускает восемь электронов, и когда она заполнена, атом становится неоном и снова инертен. Третья орбиталь снова содержит восемь, за исключением того, что в более правильной трактовке Зоммерфельда (воспроизводимой в современной квантовой механике) имеются лишние «d» электроны. Третья орбита может содержать дополнительные 10 d-электронов, но эти позиции не заполняются до тех пор, пока не будут заполнены ещё несколько орбиталей со следующего уровня (заполнение n = 3 d-орбиталей дает 10 переходных элементов). Нерегулярная картина заполнения является следствием взаимодействий между электронами, которые не учитываются ни в моделях Бора, ни в моделях Зоммерфельда и которые трудно рассчитать даже в современной трактовке.
Закон и расчет Мозли (рентгеновские эмиссионные линии K-альфа)
правитьНильс Бор сказал в 1962 году: «Видите ли, на самом деле работа Резерфорда не воспринималась всерьёз. Мы не можем понять это сегодня, но её вообще не воспринимали всерьёз. Нигде о ней не упоминалось. Всё изменилось с работы Мозли»[39].
В 1913 году Генри Мозли обнаружил эмпирическую связь между самой сильной рентгеновской линией, испускаемой атомами при электронной бомбардировке (тогда известной как линия K-альфа), и их атомным номером Z Было обнаружено, что эмпирическая формула Мозли выводится из формулы Ридберга, а затем из формулы Бора (в терминах моделей Мозли фактически упоминает только Эрнеста Резерфорда и Антониуса Ван ден Брука, поскольку они были опубликованы до работы Мозли, а статья Мозли 1913 года была опубликована в том же месяце, что и первая модель Бора)[40]. Два дополнительных предположения о том, что [1] эта рентгеновская линия возникла в результате перехода между уровнями энергии с квантовыми числами 1 и 2, и [2] что атомный номер Z, используемый в формуле для атомов тяжелее водорода, должен быть равен уменьшилось на 1, до (Z − 1)2.
Мозли написал Бору, озадаченный своими результатами, но Бор не смог помочь. В то время он думал, что постулируемая самая внутренняя оболочка электронов «K» должна иметь по крайней мере четыре электрона, а не два, которые точно объяснили бы результат. Поэтому Мозли опубликовал свои результаты без теоретического объяснения.
Вальтер Коссель в 1914 и 1916 годах объяснил, что в таблице Менделеева новые элементы будут создаваться по мере добавления электронов к внешней оболочке. В статье Косселя он пишет: «Это приводит к выводу, что электроны, добавляемые в дальнейшем, должны располагаться в концентрических кольцах или оболочках, на каждом из которых… только известное число электронов, а именно восемь в нашем случае — должено находиться. Как только одно кольцо или оболочка завершена, необходимо начинать новое для следующего элемента, число электронов, которые наиболее легко доступны и лежат на самой внешней периферии, снова увеличивается от элемента; к элементу и, следовательно, при образовании каждой новой оболочки химическая периодичность повторяется»[36][37]. Позже химик Ленгмюр понял, что эффект был вызван экранированием заряда, при этом внутренняя оболочка содержала только 2 электрона. В своей статье 1919 года Ирвинг Ленгмюр постулировал существование «ячеек», каждая из которых может содержать только два электрона, и они были расположены в «равноотстоящих друг от друга слоях».
В эксперименте Мозли один из самых внутренних электронов атома выбивается, оставляя вакансию на самой нижней орбите Бора, которая содержит единственный оставшийся электрон. Эта вакансия затем заполняется электроном со следующей орбиты, имеющей n=2. Но электроны n=2 видят эффективный заряд Z − 1, что является значением, соответствующим заряду ядра, когда одиночный электрон остаётся на самой нижней боровской орбите, экранируя заряд ядра +Z, и понижает его на −1 (из-за отрицательного заряда электрона, экранирующего положительный заряд ядра). Энергия, полученная при падении электрона со второй оболочки на первую, даёт закон Мозли для линий K-альфа:
Здесь Rv = RE/h — постоянная Ридберга, выраженная в частоте, равная 3,28 х 1015 Гц. Для значений Z от 11 до 31 это последнее соотношение было получено Мозли эмпирически на простом (линейном) графике квадратного корня из частоты рентгеновского излучения в зависимости от атомного номера (однако для серебра Z = 47 экспериментально полученное значение множителя экранировки следует заменить на 0,4). Несмотря на свою ограниченную применимость[41], закон Мозли не только установил объективное значение атомного номера, но, как заметил Бор, он также сделал больше, чем вывод Ридберга, для установления обоснованности ядерной модели Резерфорда/Ван ден Брока/Бора атома, атомный номер которого (место в таблице Менделеева) обозначает целые единицы заряда ядра. Ван ден Брук опубликовал свою модель в январе 1913 года, показывающую, что периодическая таблица упорядочена в соответствии с зарядом, тогда как атомная модель Бора не была опубликована до июля 1913 года[42].
Линия K-альфа времён Мозли теперь известна как пара близких линий, записанных как (Kα1 и Kα2) в нотации Сигбана.
Недостатки
правитьМодель Бора дает неправильное значение L=ħ для орбитального углового момента основного состояния: из эксперимента известно, что угловой момент в истинном основном состоянии равен нулю. Хотя мысленные представления несколько терпят неудачу на этих уровнях масштаба, электрон на самой нижней современной «орбитали» без орбитального момента можно считать вообще не вращающимся «вокруг» ядра, а просто плотно вращающимся вокруг него в эллипс с нулевой площадью (его можно изобразить «взад и вперёд», без соударения с ядром и взаимодействия с ним). Это воспроизводится только в более сложной полуклассической трактовке, такой как у Зоммерфельда. Тем не менее, даже самая сложная квазиклассическая модель не может объяснить тот факт, что состояние с самой низкой энергией сферически симметрично — оно не указывает в каком-либо конкретном направлении.
Тем не менее, в современной полностью квантовой трактовке в фазовом пространстве правильная деформация (осторожное полное расширение) полуклассического результата приводит значение углового момента к правильному эффективному значению[43]. Как следствие, выражение физического основного состояния получается посредством сдвига выражения исчезающего квантового углового момента, что соответствует сферической симметрии.
В современной квантовой механике электрон в водороде представляет собой сферическое облако плотности вероятности, которое уплотняется вблизи ядра. Константа скорости распада вероятности в водороде равна обратной величине радиуса Бора, но поскольку Бор работал с круговыми орбитами, а не с эллипсами нулевой площади, тот факт, что эти два числа точно совпадают, считается «совпадением». Однако между полуклассической и полной квантовомеханической трактовкой атома обнаружено множество таких совпадений; они включают идентичные энергетические уровни в атоме водорода и вывод постоянной тонкой структуры, которая возникает из релятивистской модели Бора — Зоммерфельда. (см. ниже) и которое оказывается эквивалентным совершенно другому понятию в современной квантовой механике.
Модель атома Бора также сталкивается с трудностями или не может объяснить:
- Большая часть спектров более тяжёлых атомов. В лучшем случае она может сделать предсказания о спектрах рентгеновского излучения K-альфа и некоторых L-альфа для более крупных атомов, если будут сделаны два дополнительных специальных предположения. Можно также приближенно предсказать спектры излучения атомов с одним электроном на внешней оболочке (атомы литиевой группы). Кроме того, если известны эмпирические факторы электрон-ядерного экранирования для многих атомов, на основе этой информации можно вывести многие другие спектральные линии в аналогичных атомах разных элементов с помощью комбинационных принципов Ритца — Ридберга (см. формулу Ридберга). Все эти методы по существу используют ньютоновскую картину потенциального энергии атома Бора.
- Относительные интенсивности спектральных линий; хотя в некоторых простых случаях формула Бора или её модификации могли дать разумные оценки (например, расчеты Крамерса для эффекта Штарка).
- Существование тонкой и сверхтонкой структуры в спектральных линиях, которые, как известно, обусловлены множеством релятивистских и тонких эффектов, а также осложнениями, связанными со спином электронов.
- Эффект Зеемана — изменение спектральных линий под действием внешних магнитных полей; это также связано с более сложными квантовыми принципами, взаимодействующими со спином электрона и орбитальными магнитными полями.
- Модель также нарушает принцип неопределённости, поскольку она считает, что электроны имеют известные орбиты и местоположения — две вещи, которые невозможно измерить одновременно.
- Дублеты и триплеты проявляются в спектрах некоторых атомов как очень близкие пары линий. Модель Бора не может объяснить, почему некоторые энергетические уровни должны располагаться очень близко друг к другу.
- Многоэлектронные атомы не имеют энергетических уровней, предсказываемых моделью. Она не работает для (нейтрального) гелия.
Уточнения
правитьБыло предложено несколько усовершенствований модели Бора, в первую очередь модели Зоммерфельда или Бора — Зоммерфельда, которые предполагали, что электроны перемещаются по эллиптическим орбитам вокруг ядра вместо круговых орбит модели Бора[1]. Эта модель дополнила условие квантования углового момента модели Бора дополнительным условием радиального квантования, условием квантования Уилсона — Зоммерфельда[44][45]
где pr — радиальный импульс, канонически сопряжённый с координатой qr, которая является радиальной координатой, а T — один полный орбитальный период. Интеграл — это действие в переменных действие — угол. Это условие, подсказываемое принципом соответствия, является единственно возможным, поскольку квантовые числа являются адиабатическими инвариантами.
Модель Бора — Зоммерфельда была фундаментально противоречивой и приводила ко многим парадоксам. Магнитное квантовое число измеряло наклон плоскости орбиты относительно xy плоскость, и она могла принимать только несколько дискретных значений. Это противоречило тому очевидному факту, что атом можно было поворачивать в ту или иную сторону относительно координат без ограничений. Квантование Зоммерфельда может выполняться в разных канонических координатах и иногда даёт разные ответы. Включение радиационных поправок было трудным, поскольку требовалось найти координаты действие — угол для объединённой системы излучение/атом, что затруднительно при учёте излучения. Вся теория не распространялась на неинтегрируемые движения, а это означало, что многие системы невозможно было рассматривать даже в принципе. В конце концов, модель была заменена современной квантово-механической трактовкой атома водорода, которую впервые дал Вольфганг Паули в 1925 году с использованием матричной механики Гейзенберга. Современная картина атома водорода основана на атомных орбиталях волновой механики, которые Эрвин Шрёдингер разработал в 1926 году.
Бор также обновил свою модель в 1922 году, предположив, что определённое количество электронов (например, 2, 8 и 18) соответствует стабильным «закрытым оболочкам»[46].
Формула Зоммерфельда — Дирака
правитьДвижение электрона вокруг атомного ядра в рамках классической механики можно рассматривать как «линейный осциллятор», который характеризуется «адиабатичным инвариантом», представляющим собой площадь эллипса (в обобщённых координатах):
где — обобщённый импульс и координаты электрона, — энергия, — частота. А квантовый постулат утверждает, что площадь замкнутой кривой в фазовой — плоскости за один период движения, равна целому числу, умноженному на постоянную Планка (Дебай, 1913 г.). С точки зрения рассмотрения постоянной тонкой структуры наиболее интересным является движение релятивистского электрона в поле ядра атома, когда его масса зависит от скорости движения. В этом случае мы имеем два квантовых условия:
- , ,
где определяет главную полуось эллиптической орбиты электрона ( ), а — его фокальный параметр :
- , .
В этом случае Зоммерфельд получил выражение для энергии в виде
- .
где — постоянная Ридберга, а — порядковый номер атома (для водорода ).
Дополнительный член отражает более тонкие детали расщепления спектральных термов водородоподобных атомов, а их число определяется квантовым числом . Таким образом сами спектральные линии представляют собой системы более тонких линий, которые соответствуют переходам между уровнями высшего состояния ( ) и низшего состояния ( ). Это и есть т. н. тонкая структура спектральных линий. Зоммерфельд разработал теорию тонкой структуры для водородоподобных атомов ( , , ), а Фаулер с Пашеном на примере спектра однократно ионизированного гелия установили полное соответствие теории с экспериментом.
Зоммерфельд (1916 г.) ещё задолго до возникновения квантовой механики Шредингера получил феноменологичную формулу для водородных термов в виде:
- ,
где — постоянная тонкой структуры, — порядковый номер атома, — энергия покоя, — радиальное квантовое число, а — азимутальное квантовое число. Позднее эту формулу получил Дирак, используя релятивистское уравнения Шрёдингера. Поэтому сейчас эта формула и носит имя Зоммерфельда — Дирака.
Появление тонкой структуры термов связано с прецессией электронов вокруг ядра атома. Поэтому появление тонкой структуры можно обнаружить по резонансному эффекту в области ультракоротких электромагнитных волн. В случае (атом водорода) величина расщепления близка к
Поскольку длина электромагнитной волны равна
Поэтому для это будет почти 1 см.
Однако это не означает, что модель Бора — Зоммерфельда не имела успеха. Расчёты на основе модели Бора — Зоммерфельда смогли точно объяснить ряд более сложных атомных спектральных эффектов. Например, с точностью до возмущений первого порядка модель Бора и квантовая механика делают одинаковые предсказания относительно расщепления спектральной линии при эффекте Штарка. Однако при возмущениях более высокого порядка модель Бора и квантовая механика различаются, и измерения эффекта Штарка при высоких напряженностях поля помогли подтвердить правильность квантовой механики по сравнению с моделью Бора. Преобладающая теория, лежащая в основе этого различия, заключается в форме орбиталей электронов, которые варьируются в зависимости от энергетического состояния электрона.
Условия квантования Бора — Зоммерфельда приводят к вопросам современной математики. Непротиворечивое квазиклассическое условие квантования требует определённого типа структуры фазового пространства, что накладывает топологические ограничения на типы симплектических многообразий, которые можно квантовать. В частности, симплектическая форма должна быть формой кривизны связности эрмитова линейного расслоения, которая называется предквантованием.
Модель химической связи
правитьНильс Бор предложил модель атома и модель химической связи. Согласно его модели двухатомной молекулы, электроны атомов молекулы образуют вращающееся кольцо, плоскость которого перпендикулярна оси молекулы и равноудалена от атомных ядер. Динамическое равновесие молекулярной системы достигается за счёт баланса сил между силами притяжения ядер к плоскости кольца электронов и силами взаимного отталкивания ядер. Модель химической связи Бора учитывала кулоновское отталкивание — электроны в кольце находятся на максимальном расстоянии друг от друга[47][48].
Экспериментальное подтверждение теории Бора
правитьВ 1914 году Франк и Герц поставили опыт, косвенно подтверждающий теорию Бора: атомы разреженного газа обстреливались медленными электронами с последующим исследованием распределения электронов по абсолютным значениям скоростей до и после столкновения. При упругом ударе распределение не должно меняться, так как изменяется только направление вектора скорости. Результаты показали, что при скоростях электронов меньше некоторого критического значения удары упруги, а при критической скорости столкновения становятся неупругими, электроны теряют энергию, а атомы газа переходят в возбуждённое состояние. При дальнейшем увеличении скорости удары снова становились упругими, пока не достигалась новая критическая скорость. Наблюдаемое явление позволило сделать вывод о том, что атом может или вообще не поглощать энергию, или же поглощать в количествах равных разности энергий стационарных состояний.
Примечания
править- ↑ 1 2 Lakhtakia, Akhlesh; Salpeter, Edwin E. (1996). "Models and Modelers of Hydrogen". American Journal of Physics. 65 (9): 933. Bibcode:1997AmJPh..65..933L. doi:10.1119/1.18691.
- ↑ Планетарная модель атома. Постулаты Бора Архивная копия от 21 февраля 2009 на Wayback Machine на Портале Естественных Наук Архивная копия от 26 ноября 2009 на Wayback Machine
- ↑ Perrin, Jean (1901). "Les Hypothèses moléculaires". La Revue scientifique: 463.
- ↑ Боровский радиус Архивная копия от 11 сентября 2015 на Wayback Machine согласно CODATA
- ↑ 1 2 de Broglie, Langevin, Solvay, Einstein, 1912, pp. 122–123.
- ↑ 1 2 3 4 Kragh, Helge (1979-01-01). "Niels Bohr's Second Atomic Theory". Historical Studies in the Physical Sciences. 10: 123—186. doi:10.2307/27757389. JSTOR 27757389.
- ↑ 1 2 3 4 Bohr, N. (July 1913). "I. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1—25. Bibcode:1913PMag...26....1B. doi:10.1080/14786441308634955.
- ↑ Olsen, James D.; McDonald, Kirk T. Classical lifetime of a bohr atom (2005). Архивировано 9 октября 2022 года.[самостоятельно публикуемый источник]
- ↑ CK12 – Chemistry Flexbook Second Edition – The Bohr Model of the Atom. Дата обращения: 30 сентября 2014.
- ↑ Kragh, Helge. Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure 1913–1925. — Oxford University Press, 2012. — P. 18. — ISBN 978-0-19-163046-0.
- ↑ Rayleigh, Lord (January 1906). "VII. On electrical vibrations and the constitution of the atom". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 11 (61): 117—123. doi:10.1080/14786440609463428.
- ↑ de Broglie, Langevin, Solvay, Einstein, 1912, p. 114.
- ↑ 1 2 3 Heilbron, John L. (June 2013). "The path to the quantum atom". Nature. 498 (7452): 27—30. doi:10.1038/498027a. PMID 23739408. S2CID 4355108.
- ↑ de Broglie, Langevin, Solvay, Einstein, 1912, p. 124.
- ↑ de Broglie, Langevin, Solvay, Einstein, 1912, p. 127.
- ↑ de Broglie, Langevin, Solvay, Einstein, 1912, p. 109.
- ↑ de Broglie, Langevin, Solvay, Einstein, 1912, p. 447.
- ↑ 1 2 3 Heilbron, John L.; Kuhn, Thomas S. (1969). "The Genesis of the Bohr Atom". Historical Studies in the Physical Sciences. 1: vi—290. doi:10.2307/27757291. JSTOR 27757291.
- ↑ 1 2 3 (Interview) https://www.aip.org/history-programs/niels-bohr-library/oral-histories/4517-3.
{{cite interview}}:|title=пропущен или пуст (справка) - ↑ (Interview) https://www.aip.org/history-programs/niels-bohr-library/oral-histories/4517-2.
{{cite interview}}:|title=пропущен или пуст (справка) - ↑ 1 2 Nicholson, J. W. (1912-06-14). "The Constitution of the Solar Corona. IL". Monthly Notices of the Royal Astronomical Society. 72 (8). Oxford University Press: 677—693. doi:10.1093/mnras/72.8.677. ISSN 0035-8711.
- ↑ 1 2 3 McCormmach, Russell (1966-01-01). "The atomic theory of John William Nicholson". Archive for History of Exact Sciences. 3 (2): 160—184. doi:10.1007/BF00357268. JSTOR 41133258. S2CID 120797894.
- ↑ Hirosige, Tetu; Nisio, Sigeko (1964). "Formation of Bohr's theory of atomic constitution". Japanese Studies in the History of Science (3): 6—28. OCLC 1026682346.
- ↑ Heilbron, J. L. (1964). A History of Atomic Models from the Discovery of the Electron to the Beginnings of Quantum Mechanics (Thesis).
- ↑ Wilson, William (November 1956). "John William Nicholson, 1881–1955". Biographical Memoirs of Fellows of the Royal Society. 2: 209—214. doi:10.1098/rsbm.1956.0014.
- ↑ Bohr, Niels. On the Constitution of Atoms and Molecules ... Papers of 1913 reprinted from the Philosophical Magazine, with an introduction by L. Rosenfeld / Niels Bohr, Léon Jacques Henri Constant Rosenfeld. — Copenhagen; W.A. Benjamin: New York, 1963.Ошибка: некорректно задана дата установки (исправьте через подстановку шаблона)
- ↑ Stachel, John. Bohr and the Photon // Quantum Reality, Relativistic Causality, and Closing the Epistemic Circle. — Dordrecht : Springer, 2009. — P. 79.
- ↑ Gilder, Louisa. The Arguments 1909—1935 // The Age of Entanglement. — 2009. — P. 55. — «"Well, yes," says Bohr. "But I can hardly imagine it will involve light quanta. Look, even if Einstein had found an unassailable proof of their existence and would want to inform me by telegram, this telegram would only reach me because of the existence and reality of radio waves."».
- ↑ "Revealing the hidden connection between pi and Bohr's hydrogen model". Physics World. 2015-11-17.
- ↑ Müller, U.; de Reus, T.; Reinhardt, J.; Müller, B.; Greiner, W. (1988-03-01). "Positron production in crossed beams of bare uranium nuclei". Physical Review A. 37: 1449—1455. Bibcode:1988PhRvA..37.1449M. doi:10.1103/PhysRevA.37.1449. PMID 9899816. S2CID 35364965.
- ↑ Bohr, N. (1913). "On the Constitution of Atoms and Molecules, Part II. Systems containing only a Single Nucleus". Philosophical Magazine. 26: 476—502.
- ↑ Kragh, Helge (1979-01-01). "Niels Bohr's Second Atomic Theory". Historical Studies in the Physical Sciences. 10. University of California Press: 123—186. doi:10.2307/27757389. ISSN 0073-2672. JSTOR 27757389.
- ↑ Bohr, N. (1913-11-01). "LXXIII. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (155): 857—875. Bibcode:1913PMag...26..857B. doi:10.1080/14786441308635031.
- ↑ Nicholson, J. W. (May 1914). "The Constitution of Atoms and Molecules". Nature. 93 (2324): 268—269. Bibcode:1914Natur..93..268N. doi:10.1038/093268a0. S2CID 3977652.
- ↑ Bury, Charles R. (July 1921). "Langmuir's Theory of the Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 43 (7): 1602—1609. doi:10.1021/ja01440a023.
- ↑ 1 2 Kossel, W. (1916). "Über Molekülbildung als Frage des Atombaus" [On molecular formation as a question of atomic structure]. Annalen der Physik (нем.). 354 (3): 229—362. Bibcode:1916AnP...354..229K. doi:10.1002/andp.19163540302.
- ↑ 1 2 Kragh, Helge (2012). "Lars Vegard, atomic structure, and the periodic system" (PDF). Bulletin for the History of Chemistry. 37 (1): 42—49. OCLC 797965772. S2CID 53520045. Архивировано (PDF) 9 октября 2022.
- ↑ Langmuir, Irving (June 1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868—934. doi:10.1021/ja02227a002.
- ↑ "Niels Bohr - Session I" (Interview).
- ↑ Moseley, H.G.J. (1913). "The high-frequency spectra of the elements". Philosophical Magazine. 6th series. 26: 1024—1034.
- ↑ M.A.B. Whitaker (1999). "The Bohr–Moseley synthesis and a simple model for atomic x-ray energies". European Journal of Physics. 20 (3): 213—220. Bibcode:1999EJPh...20..213W. doi:10.1088/0143-0807/20/3/312. S2CID 250901403.
- ↑ van den Broek, Antonius (January 1913). "Die Radioelemente, das periodische System und die Konstitution der. Atome". Physikalische Zeitschrift (нем.). 14: 32—41.
- ↑ Dahl, Jens Peder; Springborg, Michael (1982-12-10). "Wigner's phase space function and atomic structure: I. The hydrogen atom ground state". Molecular Physics. 47 (5): 1001—1019. doi:10.1080/00268978200100752. S2CID 9628509.
- ↑ A. Sommerfeld (1916). "Zur Quantentheorie der Spektrallinien". Annalen der Physik (нем.). 51 (17): 1—94. Bibcode:1916AnP...356....1S. doi:10.1002/andp.19163561702.
- ↑ W. Wilson (1915). "The quantum theory of radiation and line spectra". Philosophical Magazine. 29 (174): 795—802. doi:10.1080/14786440608635362.
- ↑ Shaviv, Glora. The Life of Stars: The Controversial Inception and Emergence of the Theory of Stellar Structure. — Springer, 2010. — P. 203. — ISBN 978-3642020872.
- ↑ Бор Н. Избранные научные труды (статьи 1909–1925). — М. : «Наука», 1970. — Vol. 1. — P. 133.
- ↑ Svidzinsky, Anatoly A.; Scully, Marlan O.; Herschbach, Dudley R. (2005-08-23). "Bohr's 1913 molecular model revisited". Proceedings of the National Academy of Sciences of the United States of America. 102 (34): 11985—11988. arXiv:physics/0508161. Bibcode:2005PNAS..10211985S. doi:10.1073/pnas.0505778102. PMC 1186029. PMID 16103360.
Первичные источники
править- Bohr, N. (July 1913). "I. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1—25. Bibcode:1913PMag...26....1B. doi:10.1080/14786441308634955.
- Bohr, N. (September 1913). "XXXVII. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (153): 476—502. Bibcode:1913PMag...26..476B. doi:10.1080/14786441308634993.
- Bohr, N. (1913-11-01). "LXXIII. On the constitution of atoms and molecules". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (155): 857—875. Bibcode:1913PMag...26..857B. doi:10.1080/14786441308635031.
- Bohr, N. (October 1913). "The Spectra of Helium and Hydrogen". Nature. 92 (2295): 231—232. Bibcode:1913Natur..92..231B. doi:10.1038/092231d0. S2CID 11988018.
- Bohr, N. (March 1921). "Atomic Structure". Nature. 107 (2682): 104—107. Bibcode:1921Natur.107..104B. doi:10.1038/107104a0. S2CID 4035652.
- A. Einstein (1917). "Zum Quantensatz von Sommerfeld und Epstein". Verhandlungen der Deutschen Physikalischen Gesellschaft. 19: 82—92. Reprinted in The Collected Papers of Albert Einstein, A. Engel translator, (1997) Princeton University Press, Princeton. 6 p. 434. (provides an elegant reformulation of the Bohr–Sommerfeld quantization conditions, as well as an important insight into the quantization of non-integrable (chaotic) dynamical systems.)
- de Broglie, Maurice. La théorie du rayonnement et les quanta : rapports et discussions de la réunion tenue à Bruxelles, du 30 octobre au 3 novembre 1911, sous les auspices de M.E. Solvay : [] / Maurice de Broglie, Paul Langevin, Ernest Solvay … [и др.]. — Gauthier-Villars, 1912.
Литература
править- Борн М. Атомная физика, 2-е изд. — М.: Мир, 1967, 493 с.
- Джеммер, Макс. Эволюция понятий квантовой механики / Пер. с англ. / Под ред. Л. И. Пономарёва. — М.: Наука, 1985. — С. 11. — 384 с.
- Милантьев В. П. История возникновения квантовой механики и развитие представлений об атоме. — М.: Книжный дом «ЛИБРОКОМ», 2017, 246 с. ISBN 978-5-397-05872-8.
- Linus Carl Pauling. Chapter 5-1 // General Chemistry. — 3rd. — San Francisco : W.H. Freeman & Co, 1970.
- Reprint: Linus Pauling. General Chemistry. — New York : Dover Publications, 1988. — ISBN 0-486-65622-5.
- George Gamow. Chapter 2 // Thirty Years That Shook Physics. — Dover Publications, 1985.
- Walter J. Lehmann. Chapter 18 // Atomic and Molecular Structure: the development of our concepts. — John Wiley and Sons, 1972. — ISBN 0-471-52440-9.
- Paul Tipler and Ralph Llewellyn. Modern Physics. — 4th. — W. H. Freeman, 2002. — ISBN 0-7167-4345-0.
- Klaus Hentschel: Elektronenbahnen, Quantensprünge und Spektren, in: Charlotte Bigg & Jochen Hennig (eds.) Atombilder. Ikonografien des Atoms in Wissenschaft und Öffentlichkeit des 20. Jahrhunderts, Göttingen: Wallstein-Verlag 2009, pp. 51–61
- Steven and Susan Zumdahl. Chapter 7.4 // Chemistry. — 8th. — Brooks/Cole, 2010. — ISBN 978-0-495-82992-8.
- Kragh, Helge (November 2011). "Conceptual objections to the Bohr atomic theory — do electrons have a 'free will'?". The European Physical Journal H. 36 (3): 327—352. Bibcode:2011EPJH...36..327K. doi:10.1140/epjh/e2011-20031-x. S2CID 120859582.
Для улучшения этой статьи по физике желательно:
|
В сносках к статье найдены неработоспособные вики-ссылки. |

