Плутоний
Плуто́ний (обозначается символом Pu; атомное число 94) — тяжёлый хрупкий высокотоксичный радиоактивный металл серебристо-белого цвета[10][11]. В периодической таблице располагается в семействе актиноидов.
| Плутоний | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Нептуний | Америций → | |||||||||||||||
| |||||||||||||||
| Внешний вид простого вещества | |||||||||||||||
| Радиоактивный серебристый металл | |||||||||||||||
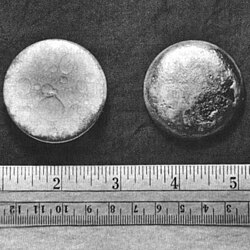 Образец плутония |
|||||||||||||||
| Свойства атома | |||||||||||||||
| Название, символ, номер | Плуто́ний / Plutonium (Pu), 94 | ||||||||||||||
| Тип группы | Актиноиды | ||||||||||||||
| Группа, период, блок | 7, 3, f | ||||||||||||||
| Атомная масса (молярная масса) |
244,0642 а. е. м. (г/моль) | ||||||||||||||
| Электронная конфигурация | [Rn] 5f6 7s2 | ||||||||||||||
| Радиус атома | 162[1][2] пм | ||||||||||||||
| Химические свойства | |||||||||||||||
| Радиус Ван-дер-Ваальса | 200[3] пм | ||||||||||||||
| Радиус иона |
Pu3+: 100 пм, Pu4+: 86 пм, Pu5+: 74 пм, Pu6+: 71[4] пм |
||||||||||||||
| Электроотрицательность | 1,28 (шкала Полинга) | ||||||||||||||
| Электродный потенциал |
Pu←Pu4+ −1,25 В, Pu←Pu3+ −2,0 В, Pu←Pu2+ −1,2 В |
||||||||||||||
| Степени окисления | +2, +3, +4, +5, +6, +7[5] | ||||||||||||||
| Энергия ионизации (первый электрон) |
584,7 (6,06)[6] кДж/моль (эВ) | ||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||
| Термодинамическая фаза | Металл | ||||||||||||||
| Плотность (при н. у.) | 19,84 г/см³ | ||||||||||||||
| Температура плавления | 639,7 °C; 912 K; 1182 °F [1] | ||||||||||||||
| Температура кипения | 3235 °C; 3507 K; 5855 °F [1] | ||||||||||||||
| Мол. теплота плавления | 2,8 кДж/моль | ||||||||||||||
| Мол. теплота испарения | 343,5 кДж/моль | ||||||||||||||
| Молярная теплоёмкость | 32,77[7] Дж/(K·моль) | ||||||||||||||
| Молярный объём | 12,12 см³/моль | ||||||||||||||
|
|||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||
| Структура решётки | Моноклинная | ||||||||||||||
| Параметры решётки |
a=6,183 Å b=4,822 Å c=10,963 Å β=101,8°[9] |
||||||||||||||
| Температура Дебая | 162 K | ||||||||||||||
| Прочие характеристики | |||||||||||||||
| Теплопроводность | (300 K) 6,74 Вт/(м·К) | ||||||||||||||
| Скорость звука | 2260[6] м/с | ||||||||||||||
| Номер CAS | 7440-07-5 | ||||||||||||||
| 94 | Плутоний
|
| 5f67s2 | |
Для этого элемента характерны существенно отличающиеся от остальных элементов структурные и физико-химические свойства[10]. Плутоний имеет семь аллотропных модификаций при определённых температурах и диапазонах давления[12]: α, β, γ, δ, δ', ε и ζ. Может принимать степени окисления от +2 до +7, основными считаются +4, +5, +6. Плотность варьируется от 19,8 (α-Pu) до 15,9 г/см³ (δ-Pu).
Плутоний не имеет стабильных изотопов[5]. В природе в следовых количествах присутствуют самый долгоживущий изотоп из всех трансурановых элементов 244Pu и его дочерний нуклид 240Pu, а также 239Pu[1][13][14] и 238Pu. В окружающей среде находится преимущественно в виде диоксида (PuO2), который в воде менее растворим, чем песок (кварц)[11]. Нахождение элемента в природе настолько мало, что его добыча нецелесообразна[~ 1].
Второй после нептуния (который был ошибочно «получен» в 1934 году группой Энрико Ферми[15][16]; его первый изотоп 239Np синтезирован и идентифицирован в мае 1940 года Эдвином Макмилланом и Филипом Абельсоном[17][18][19]) искусственный элемент, полученный в чрезвычайно маленьких количествах в конце 1940 г. в виде изотопа 238Pu[13].
Первый искусственный химический элемент, производство которого началось в промышленных масштабах[20] (в СССР с 1946 года в Челябинске-40 было создано предприятие по производству оружейного урана и плутония[21]). США, а затем и СССР были первыми странами, освоившими его получение.
Плутоний получают из природного изотопа урана U238. Общее количество плутония, хранящегося в мире во всевозможных формах, оценивалось в 2003 г. в 1239 т[22].
Плутоний используется в производстве ядерного оружия (так называемый «оружейный плутоний»), топлива для ядерных реакторов гражданского и исследовательского назначения и в качестве источника энергии для космических аппаратов[23]. В первой ядерной бомбе в мире, созданной и испытанной в 1945 году в США, использовался плутониевый заряд. Того же типа была и первая атомная бомба, испытанная СССР в 1949 году[24].
В таблице справа приведены основные свойства для α-плутония. Данная аллотропная модификация является основной для плутония при комнатной температуре и нормальном давлении.
- 7440-07-5 для плутония неспецифического состава,
- 13981-16-3 для 238Pu,
- 15117-48-3 для 239Pu,
- 14119-33-6 для 240Pu.
История править
Открытие править
Энрико Ферми вместе со своими сотрудниками в Университете Рима сообщил, что они обнаружили химический элемент с порядковым номером 94, в 1934 году[25]. Ферми назвал этот элемент гесперием, сделав таким образом предположение о существовании трансурановых элементов и став их теоретическим первооткрывателем. Он придерживался этой позиции и в своей Нобелевской лекции в 1938 году, однако, узнав об открытии Отто Ганом и Фрицем Штрассманом деления ядра, был вынужден сделать в печатной версии, вышедшей в Стокгольме в 1939 году, примечание, указывающее на необходимость пересмотра «всей проблемы трансурановых элементов». Работа немецких учёных показала, что активность, обнаруженная Ферми в его экспериментах, была обусловлена именно делением, а не открытием трансурановых элементов, как он ранее полагал[26][27][28].
Открытие плутония группой сотрудников Калифорнийского университета в Беркли под руководством Г. Т. Сиборга было совершено с помощью 60-дюймового циклотрона. Первая бомбардировка октаоксида триурана-238 (238U3O8) дейтронами, разогнанными в циклотроне до 14—22 МэВ и проходящими через алюминиевую фольгу толщиной 0,002 дюйма (50,8 мкм), была произведена 14 декабря 1940 года. Сравнивая образцы, полученные и выдержанные в течение 2,3 суток, с выделенной фракцией чистого нептуния, учёные обнаружили существенную разницу в их альфа-активностях и предположили, что её рост через 2 суток обусловлен влиянием нового элемента, являющегося дочерним по отношению к нептунию. Дальнейшие физические и химические исследования продолжались 2 месяца. В ночь с 23 на 24 февраля 1941 года[29] был проведён решающий эксперимент по окислению предполагаемого элемента с помощью пероксиддисульфат-ионов и ионов серебра в качестве катализатора, который показал, что нептуний-238 спустя два дня претерпевает бета-минус-распад и образует химический элемент под номером 94 в следующей реакции:
Существование нового химического элемента было подтверждено экспериментально Г. Т. Сиборгом, Э. М. Макмилланом, Дж. В. Кеннеди и А. К. Валем благодаря изучению его первых химических свойств. Было выяснено, что плутоний может находиться, по крайней мере, в двух степенях окисления[33][34][35][36][10][37][35][38][39][40][~ 2].
Немного позднее было установлено, что этот изотоп является неделящимся (пороговым), а следовательно, неинтересным для дальнейших исследований в военных целях, так как пороговые ядра не могут служить основой цепной реакции деления. Поняв это, физики-ядерщики США направили свои усилия на получение делящегося изотопа-239 (который по расчётам должен был быть более мощным источником атомной энергии, чем уран-235[36]). В марте 1941 года 1,2 кг чистейшей соли урана, замурованной в большой парафиновый блок, подвергли в циклотроне бомбардировке нейтронами. На протяжении двух суток длилась бомбардировка урановых ядер, в результате чего были получены приблизительно 0,5 мкг плутония-239. Появление нового элемента, как и было предсказано теорией, сопровождалось потоком альфа-частиц[41].
28 марта 1941 года проведённые эксперименты показали, что 239Pu способен делиться под действием медленных нейтронов, с сечением, весьма значительно превышающим сечение для 235U, причём нейтроны, полученные в процессе деления, пригодны для получения следующих актов ядерного деления, то есть позволяют рассчитывать на осуществление цепной ядерной реакции. С этого момента были начаты опыты по созданию плутониевой ядерной бомбы и строительства реакторов для его наработки[35][37][42]. Первое чистое соединение элемента было получено в 1942 году[35], а первые весовые количества металлического плутония — в 1943 году[43].
В работе, отправленной на публикацию в журнал Physical Review в марте 1941 г., был описан метод получения и изучения элемента[37]. Однако публикация этой работы была остановлена после того, как были получены данные, что новый элемент может быть использован в ядерной бомбе. Публикация работы произошла спустя год после Второй мировой войны из соображений безопасности[44] и с некоторыми корректировками[45].
В Третьем рейхе исследователи атома также не оставались бездеятельными. В лаборатории Манфреда фон Ардена были разработаны методы получения 94-го элемента. В августе 1941 года физик Фриц Хоутерманс закончил свой секретный доклад «К вопросу о развязывании цепных ядерных реакций». В нём он указывал на теоретическую возможность изготовления в урановом «котле» нового взрывчатого вещества из природного урана.
Происхождение названия править
В 1930 году была открыта новая планета, о существовании которой давно говорил Персиваль Ловелл — астроном, математик и автор фантастических очерков о жизни на Марсе. На основе многолетних наблюдений за движениями Урана и Нептуна он пришёл к заключению, что за Нептуном в Солнечной системе должна быть ещё одна, девятая планета, располагающаяся от Солнца в сорок раз дальше, чем Земля. Элементы орбиты новой планеты были им рассчитаны в 1915 году. Плутон был обнаружен на фотографических снимках, полученных 21, 23 и 29 января 1930 г. астрономом Клайдом Томбо в обсерватории Лоуэлла во Флагстаффе (США). Планета была открыта 18 февраля 1930 года[46]. Название планете было дано одиннадцатилетней школьницей из Оксфорда Венецией Бёрни[47]. В греческой мифологии Аид (в римской Плутон) является богом царства мёртвых.
Первое печатное упоминание термина плутоний датируется 21 марта 1942 года[48]. Название 94-му химическому элементу было предложено Артуром Валем и Гленном Сиборгом[49]. В 1948 году Эдвин Макмиллан предложил назвать 93-й химический элемент нептунием, так как планета Нептун — первая за Ураном. По аналогии в честь второй планеты за Ураном, Плутона, был назван плутоний[50][51]. Открытие плутония произошло через 10 лет после открытия карликовой планеты (примерно такой же отрезок времени понадобился на открытие Урана и на именование 92-го химического элемента)[15][~ 3].
Первоначально Сиборг предложил назвать новый элемент «плутием», однако позже решил, что название «плутоний» звучит лучше[52]. Для обозначения элемента он в шутку привёл две буквы «Pu» — это обозначение представилось ему наиболее приемлемым в периодической таблице[~ 4]. Также Сиборгом были предложены некоторые другие варианты названий, например, ультимий (англ. ultimium от лат. ultimus — последний), экстремий (extremium от лат. extremus — крайний), из-за ошибочного в то время суждения, что плутоний станет последним химическим элементом в периодической таблице[49]. Однако элемент назвали «плутоний» в честь последней планеты Солнечной системы[15].
Первые исследования править
После нескольких месяцев первоначальных исследований химии плутония было выявлено, что она имеет много общего с химией урана[37][уточнить]. Дальнейшие исследования были продолжены в секретной металлургической лаборатории Чикагского университета (лаборатория Джона Герберта Джонса). Благодаря[уточнить] Каннингему и Вернеру 18 августа 1942 года был выделен первый микрограмм чистого соединения плутония из 90 кг уранилнитрата, облучённого нейтронами на циклотроне[45][53][54][55]. 10 сентября 1942 года — спустя месяц, на протяжении которого учёные увеличивали количество соединения — произошло взвешивание. Этот исторический образец весил 2,77 мкг и представлял собой диоксид плутония[56]. В настоящее время он хранится в Лоуренсовском зале в Беркли[13]. К концу 1942 года было накоплено 500 мкг соли элемента. Для более подробного изучения нового элемента в США было сформировано несколько групп[45]:
- группа учёных, которая должна была выделить чистый плутоний химическими методами (Лос-Аламос: J. W. Kennedy, C. S. Smith, A. C. Wahl, C. S. Garner, I. B. Johns),
- группа, которая изучала поведение плутония в растворах, включая изучение его степеней окисления, потенциалов ионизации и кинетику реакций (Беркли: W. M. Latimer, E. D. Eastman, R. E. Connik, J. W. Gofman и др.),
- группа, которая изучала химию комплексообразования ионов плутония (Айова: F. H. Spedding, W. H. Sullivan, A. F. Voigt, A. S. Newton) и другие группы.
В ходе исследований было установлено, что плутоний может находиться в степенях окисления от 3 до 6, и что более низшие степени окисления, как правило, более стабильны по сравнению с нептунием. Тогда же было установлено сходство химических свойств плутония и нептуния[45]. В 1942 году неожиданным стало открытие Стэна Томсона, входящего в группу Гленна Сиборга, которое показало, что четырёхвалентный плутоний получается в бо́льших количествах при нахождении в кислом растворе в присутствии фосфата висмута(III) (BiPO4)[36]. В дальнейшем это привело к изучению и применению висмут-фосфатного метода экстракции плутония[57]. В ноябре 1943 г. некоторые количества фторида плутония(III) (PuF3) были подвергнуты разделению для получения чистого образца элемента в виде нескольких микрограммов мелкодисперсного порошка. Впоследствии были получены образцы, которые можно было бы рассмотреть невооружённым глазом[58].
В СССР первые опыты по получению 239Pu были начаты в 1943—1944 гг. под руководством академиков И. В. Курчатова и В. Г. Хлопина. В короткий срок в СССР были выполнены обширные исследования свойств плутония[59]. В начале 1945 года на первом в Европе циклотроне, построенном в 1937 году в Радиевом институте, был получен первый советский образец плутония путём нейтронного облучения ядер урана[33][60]. В городе Озёрск с 1945 года началось строительство первого промышленного ядерного реактора по производству плутония, первый объект ПО Маяк, пуск которого был осуществлён 19 июня 1948 года[61].
Производство в Манхэттенском проекте править
Манхэттенский проект берёт своё начало с так называемого письма Эйнштейна Рузвельту, в котором внимание президента обращалось на то, что нацистская Германия ведёт активные исследования, в результате которых может вскоре обзавестись атомной бомбой[62]. В результате положительного ответа Франклина Рузвельта в США был образован Манхэттенский проект[63].
Во время Второй мировой войны целью проекта являлось создание ядерной бомбы. Проект атомной программы (англ. atomic program), из которой образовался Манхэттенский проект, был одобрен и одновременно создан указом Президента США 9 октября 1941 года. Свою деятельность Манхэттенский проект начал 12 августа 1942 года[64]. Тремя его основными направлениями являлись[65]:
- организация производства плутония на территории Хэнфордского комплекса,
- организация обогащения урана в городе Ок-Ридж, штат Теннесси,
- исследования в области ядерного оружия и создания атомной бомбы на территории Лос-Аламосской национальной лаборатории.
Первым ядерным реактором, позволявшим получать бо́льшие количества элемента по сравнению с циклотронами, была Чикагская поленница-1[35]. Он был введён в эксплуатацию 2 декабря 1942 года благодаря Энрико Ферми и Лео Силларду[66] (последнему принадлежит предложение об использовании графита как замедлителя нейтронов[67]); в этот день была произведена первая самоподдерживающаяся ядерная цепная реакция[68]. Для производства плутония-239 использовались уран-238 и уран-235. Реактор был сооружён под трибунами стадиона Stagg Field Чикагского университета[35]. Он состоял из 6 тонн металлического урана, 34 тонн оксида урана и 400 тонн «чёрных кирпичей» графита. Единственным, что могло остановить цепную ядерную реакцию, были стержни из кадмия, которые хорошо захватывают тепловые нейтроны и, как следствие, могут предотвратить возможное происшествие[69]. Из-за отсутствия радиационной защиты и охлаждения его обычная мощность была всего 0,5…200 Вт[35].
Вторым реактором, который позволил получать плутоний-239, был Графитовый реактор X-10[37]. Он был введён в эксплуатацию 4 ноября 1943 года[70] (строительство длилось 11 месяцев) в городе Оук-Ридж, в настоящее время он располагается на территории Оук-Риджской национальной лаборатории. Этот реактор был вторым в мире после Чикагской поленницы-1 и первым реактором, который был создан в продолжении Манхэттенского проекта[71]. Реактор был первым шагом на пути к созданию более мощных ядерных реакторов (на территории Хэнфорда, Вашингтон), то есть он был экспериментальным. Окончание его работы наступило в 1963 г.[72]; открыт для посещения с 1980-х годов и является одним из старейших ядерных реакторов в мире[73].
Пятого апреля 1944 года Эмилио Сегре получил первые образцы плутония, произведённого в реакторе X-10[72]. В течение 10 дней он обнаружил, что концентрация плутония-240 в реакторе очень высока, по сравнению с циклотронами. Данный изотоп имеет очень высокую способность к спонтанному делению, в результате чего повышается общий фон нейтронного облучения[74]. На данном основании был сделан вывод, что использование особо чистого плутония в ядерной бомбе пушечного типа, в частности, в бомбе Худой, может привести к преждевременной детонации[75]. Благодаря тому, что технология разработок ядерных бомб всё более улучшалась, было установлено, что для ядерного заряда лучше всего использовать имплозионную схему с зарядом сферической формы.
Первым промышленным ядерным реактором по производству 239Pu является реактор B, расположенный в США. Строительство началось с июня 1943 г. и закончилось в сентябре 1944 г. Мощность реактора составила 250 МВт (в то время как у X-10 всего 1000 кВт). В качестве теплоносителя в этом реакторе впервые применялась вода[76]. Реактор B (вместе с реактором D и реактором F — остальными двумя) позволил получить плутоний-239, который был впервые использован в испытании Тринити. Ядерные материалы, полученные на этом реакторе, были использованы в бомбе, сброшенной на Нагасаки 9 августа 1945 г[77]. Построенный реактор был закрыт в феврале 1968 года и расположен[прояснить] в пустынном районе штата Вашингтон, недалеко от города Ричланд[78].
Стиль этого раздела неэнциклопедичен или нарушает нормы литературного русского языка. |
В ходе Манхэттенского проекта на базе Хэнфордского завода (основан в 1943 г. для производства плутония и закрыт в 1988 году вместе с окончанием производства[79]) было создано множество объектов предназначенных для получения, хранения, переработки и использования ядерных материалов. На территории комплекса был создан полигон ядерных отходов, где в данный момент расположено около 205 кг изотопов плутония (239Pu—241Pu)[80]. Было создано множество сооружений для изоляции девяти ядерных реакторов наработки плутония и многочисленных вспомогательных построек, которые загрязняли окружающую среду. Также были созданы технологические линии, главной целью которых было отделение урана от плутония химическими методами. После закрытия завода, с его территории (по состоянию на 2009 г.) было утилизировано более 20 т плутония в безопасных формах (для предотвращения ядерного деления)[79].
В 2004 г. в результате раскопок были обнаружены захоронения на территории Хэнфордского комплекса. В числе них был найден оружейный плутоний, который находился в стеклянном сосуде. Этот образец оружейного плутония оказался самым долгоживущим и был исследован Тихоокеанской национальной лабораторией. Результаты показали, что этот образец был создан на графитовом реакторе X-10 в 1944 году[81][82][83][84].
Один из участников проекта (Алан Мэй) был причастен к тайной передаче чертежей о принципах устройства урановой и плутониевой бомб, а также образцов урана-235 и плутония-239 СССР[62].
Тринити и Толстяк править
Первое ядерное испытание под названием Тринити, проведённое 16 июля 1945 г. возле города Аламогордо, Нью-Мексико, использовало плутоний в качестве ядерного заряда[58][85][86]. В Штучке (взрывное устройство) использовались обычные линзы[~ 5] для того, чтобы сжать плутоний для достижения критических размеров и плотности. Это устройство было создано для пробы нового типа ядерной бомбы «Толстяк» на основе плутония[87]. Одновременно с этим из Ежа начали поступать нейтроны для ядерной реакции. Устройство было сделано из полония и бериллия[37]; этот источник применялся в первом поколении ядерных бомб[88], так как в то время единственным источником нейтронов считалась эта композиция[33][~ 6]. Вся эта композиция позволила достичь мощного ядерного взрыва. Полная масса бомбы, использованной при ядерном испытании Тринити, составляла 6 т, хотя в ядре бомбы было всего 6,2 кг плутония[89], а предполагаемая высота для взрыва над городом составляла 225—500 м[90]. Приблизительно 20 % использованного плутония в этой бомбе составило 20 000 т в тротиловом эквиваленте[91].
Бомба Толстяк была сброшена на Нагасаки 9 августа 1945. В результате взрыва моментально погибло 70 тыс. человек и ранено ещё 100 тыс.[37]. Она имела схожий механизм: сделанное из плутония ядро помещалось в сферическую алюминиевую оболочку, которая обкладывалась химической взрывчаткой. Во время детонирования оболочки плутониевый заряд сжимался со всех сторон и его плотность перерастала критическую, после чего начиналась цепная ядерная реакция[92]. В Малыше, сброшенном на Хиросиму тремя днями ранее, использовался уран-235, но не плутоний. Япония 15 августа подписала соглашение о капитуляции. После этих случаев в СМИ было опубликовано сообщение о применении нового химического радиоактивного элемента — плутония.
Холодная война править
Большие количества плутония были произведены во время Холодной войны США и СССР. Реакторы США, находящиеся в Savannah River Site (Северная Каролина) и Хэнфорде, во время войны произвели 103 т плутония[93], в то время как СССР произвёл 170 т оружейного плутония[94]. На сегодня около 20 т плутония в ядерной энергетике производится как побочный продукт ядерных реакций[95]. На 1000 т плутония, находящегося в хранилищах, приходится 200 т плутония, извлечённого из ядерных реакторов[37]. На 2007 год СИИПМ оценил мировое количество плутония в 500 т, который примерно одинаково разделён на оружейные и энергетические нужды[96].
Сразу же по окончании Холодной войны все ядерные запасы стали проблемой распространения ядерного оружия*. Например, в США из извлечённого из ядерного оружия плутония были сплавлены двухтонные блоки, в которых элемент находится в виде инертного оксида плутония(IV)[37]. Данные блоки застеклены боросиликатным стеклом с примесью циркония и гадолиния[~ 7]. Затем эти блоки были покрыты нержавеющей сталью и захоронены на глубине 4 км[37]. Местная и государственная власть США не позволила складировать ядерные отходы в гору Юкка. В марте 2010 г. власти США решили отозвать лицензию на право складировать ядерные отходы. Барак Обама предложил провести ревизию политики хранения отходов и предоставить рекомендации по разработке новых эффективных методов по контролю над отработанным топливом и отходами[97].
Медицинские эксперименты править
На протяжении Второй мировой войны и после её окончания учёные проводили эксперименты на животных и людях, вводя внутривенно дозы плутония[98]. Исследования на животных показали, что несколько миллиграммов плутония на килограмм ткани — смертельная доза[99]. «Стандартная» доза составляла 5 мкг плутония[98], а в 1945 году эта цифра уменьшилась до 1 мкг за счёт того, что плутоний склонен к накоплению в костях и из-за этого более опасен, чем радий[99].
Восемнадцать испытаний плутония на людях были проведены в США под руководством Джозефа Гилберта Гамильтона без предварительного согласия испытуемых для того, чтобы выяснить, где и как концентрируется плутоний в человеческом организме, и выработать стандарты безопасности обращения с ним. Первые места, в которых проводились эксперименты в рамках Манхэттенского проекта, были: Хэнфорд, Беркли, Лос-Аламос, Чикаго, Оук-Ридж, Рочестер[98].
Свойства править
Физические свойства править
Плутоний, как и большинство металлов, имеет яркий серебристый цвет, похожий на никель или железо[1], но на воздухе окисляется, меняя свой цвет сначала на бронзовый, затем на синий цвет закалённого металла и после превращается в тусклый чёрный или зелёный цвет из-за образования рыхлого оксидного покрытия[100]. Также есть сообщения об образовании жёлтого и оливкового цвета оксидной плёнки[101][102]. При комнатной температуре плутоний находится в α-форме — это наиболее распространённая для плутония аллотропная модификация. Данная структура примерно такая же жёсткая, как серый чугун, если она не легирована другими металлами, которые придадут сплаву пластичность и мягкость. В отличие от большинства металлов, он не является хорошим проводником тепла и электричества[101].
Плутоний имеет аномально низкую для металлов температуру плавления (примерно 640 °C)[103] и необычно высокую температуру кипения (3235 °C)[1][~ 9]. Свинец является более лёгким металлом, чем плутоний[104] примерно в два раза (разница в плотности составляет 19,86 − 11,34 ≈ 8,52 г/см³)[11].
| Некоторые физические свойства плутония[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Как и у остальных металлов, коррозия плутония увеличивается с увеличением влажности. Некоторые исследования утверждают, что влажный аргон может быть более корродирующим элементом, чем кислород; это связано с тем, что аргон не реагирует с плутонием, и, как следствие, плутоний начинает растрескиваться[105][~ 10].
Альфа-распад, который сопровождается испусканием ядер гелия, является наиболее распространённым видом радиоактивного распада изотопов плутония[106]. Тепло, производимое благодаря распаду ядер и испусканию ими альфа-частиц, делает плутоний тёплым на ощупь[51][107].
Как известно, электрическое сопротивление характеризует способность материала проводить электрический ток. Удельное сопротивление плутония при комнатной температуре очень велико для металла, и эта особенность будет усиливаться с понижением температуры, что для металлов не свойственно[58]. Эта тенденция продолжается вплоть до 100 K[103]; ниже этой отметки электрическое сопротивление будет уменьшаться[58]. С понижением отметки до 20 K сопротивление начинает возрастать из-за радиационной активности металла, причём данное свойство будет зависеть от изотопного состава металла[58].
Плутоний обладает самым высоким удельным электрическим сопротивлением среди всех изученных актиноидов (на данный момент), которое составляет 150 мкОм·см (при +22 °C)[68]. Его твёрдость составляет 261 кг/мм³ (для α-Pu)[10].
Благодаря тому, что плутоний радиоактивен, он со временем претерпевает изменения в своей кристаллической решётке[108]. Плутоний претерпевает некое подобие отжига также благодаря самооблучению из-за повышения температуры выше 100 K.
В отличие от большинства материалов, плотность плутония увеличивается на 2,5 % при нагревании его до температуры плавления, в то время как у обычных металлов наблюдается уменьшение плотности при повышении температуры[58]. Ближе к точке плавления жидкий плутоний имеет очень высокий показатель поверхностного натяжения и самую высокую вязкость среди других металлов[103][108]. Характерной особенностью плутония является его уменьшение в объёме в диапазоне температур от 310 до 480 °C, в отличие от других металлов[59].
Аллотропные модификации править
Этот раздел не завершён. |
Плутоний имеет семь аллотропных модификаций. Шесть из них (см. рисунок выше) существуют при обычном давлении, а седьмая — только при высокой температуре и определённом диапазоне давления[12]. Эти аллотропы, которые различаются по своим структурным характеристикам и показателями плотности, имеют очень похожие значения внутренней энергии. Это свойство делает плутоний очень чувствительным к колебаниям температуры и давления, и приводит к скачкообразному изменению своей структуры[108]. Показатель плотности всех аллотропных модификаций плутония варьируется от 15,9 г/см³ до 19,86 г/см³[95][~ 11]. Наличие многих аллотропных модификаций у плутония делает его трудным металлом в обработке и выкатывании[1], так как он претерпевает фазовые переходы. Причины существования столь разных аллотропных модификаций у плутония не совсем ясны.
| Свойства кристаллических решёток плутония[13][109][110] | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Фаза | Изображение | Область устойчивости, °C | Симметрия и пространственная группа | Параметры решётки, Å | Число атомов в элементарной ячейке | Рентгеновская плотность, г/см³ | Температура перехода, °C | ΔHперехода, Дж/моль | |||
| a | b | c | β | ||||||||
| α | Ниже 122 | ПМ, P21/m | При 21 °C | 16 | 19,86 | — | — | ||||
| 6,183 | 4,882 | 10,963 | 101,79° | ||||||||
| β | — | 122—207 | ОЦМ, 12/m | При 100 °C | 34 | 17,7 | α→β 122±4 |
3430 | |||
| 9,284 | 10,463 | 7,859 | 93,13° | ||||||||
| γ | 207—315 | ГЦО, Fddd | При 235 °C | 8 | 17,14 | β→γ 207±5 |
565 | ||||
| 3,159 | 5,768 | 10,162 | — | ||||||||
| δ | 315—457 | ГЦК, Fm3m | При 320 °C | 4 | 15,92 | γ→δ 315±3 |
586 | ||||
| 4,6371 | — | — | — | ||||||||
| δ’ | 457—479 | ОЦТ, 14/mmm | При 465 °C | 2 | 16 | δ→δ’ 457±2 |
84 | ||||
| 3,34 | — | 4,44 | — | ||||||||
| ε | 479—640 | ОЦК, Im3m | При 490 °C | 2 | 16,51 | δ’→ε 479±4 |
1841 | ||||
| 3,634 | — | — | — | ||||||||
Первые три кристаллические модификации — α-, β- и γ-Pu — обладают сложной кристаллической структурой с четырьмя ярко выраженными связями ковалентного характера. Другие — δ-, δ’- и ε-Pu — более высокотемпературные модификации характеризуются более простой структурой[111].
Альфа-форма существует при комнатной температуре в виде нелегированного и необработанного плутония. Она имеет схожие свойства с чугуном, однако имеет свойство превращаться в пластичный материал и образовывать ковкую β-форму при более высоких интервалах температуры[58]. Альфа-форма плутония имеет низкосимметричную моноклинную структуру (кристаллическая структура фаз, которые существуют при комнатных температурах, является низкосимметричной, что более характерно для минералов, чем для металлов), отсюда становится ясным, что она является прочной и плохо проводящей электрический ток модификацией[12]. В данной форме плутоний очень хрупок, однако имеет самую высокую плотность из всех аллотропных модификаций[112]. Фазы плутония характеризуются резким изменением механических свойств — от совершенно хрупкого до пластичного металла[103].
Плутоний в δ-форме обычно существует при значениях температуры от 310 °C до 452 °C, однако может быть стабилен и при комнатной температуре, если он легирован галлием, алюминием или церием. Сплав плутония с небольшим количеством одного или нескольких этих металлов может быть использован при сварке[58]. Дельта-форма имеет более[чего?] ярко выраженные характеристики металла, а по прочности и ковкости сравнима с алюминием.[источник не указан 917 дней]
В ядерном оружии ударная волна сферической формы, образованная взрывными линзами, для одновременной детонации которых применяется детонационная разводка, используется для равномерного обжатия пустотелого плутониевого ядра, основным свойством которого становится резкое увеличение плотности плутония, вследствие перехода в другую аллотропную форму. Данные действия и позволят достичь критической массы плутония[113].
У плутония в эпсилон-фазе наблюдается аномально высокий показатель атомной самодиффузии[108].
Плутоний начинает уменьшаться в объёме, когда переходит в δ и δ’-фазы, что объясняется отрицательным коэффициентом термического расширения[103].
Соединения и химические свойства править
Актиноиды имеют схожие между собой химические свойства. Меньше всего степеней окисления имеют первые два актиноида и актиний (разброс значений от 3 до 5), далее эти значения увеличиваются и достигают своего пика у плутония и нептуния, затем, после америция, это число опять уменьшается. Данное свойство можно объяснить сложностью поведения электронов у ядер элементов. В 1944 году Гленном Сиборгом была выдвинута гипотеза об актиноидном сжатии, которая предполагает постепенное уменьшение радиусов ионов актиноидов (это же характерно и для лантаноидов). До её выдвижения первые актиноиды (торий, протактиний и уран) относили к элементам 4, 5 и 6-й групп соответственно[68][114].
Плутоний является химически активным металлом[101]. В 1967 году советские учёные установили, что высшая степень окисления нептуния и плутония не 6, а 7[115]. Для этого учёным пришлось окислять озоном PuO22+ в щелочной среде[7]. Плутоний проявляет четыре степени окисления в водных растворах и одну очень редкую[95]:
- PuIII, в качестве Pu3+ (светло-фиолетовый),
- PuIV, в качестве Pu4+ (шоколадный),
- PuV, в качестве PuO2+ (светлый)[~ 12],
- PuVI, в качестве PuO22+ (светло-оранжевый),
- PuVII, в качестве PuO53− (зелёный) — также присутствуют семивалентные ионы.
Цвета водных растворов плутония зависят от степени окисления и солей кислот[116]. В них плутоний может находиться сразу в нескольких степенях окисления, что объясняется близостью его редокс-потенциалов[117], что, в свою очередь, объясняется наличием 5f-электронов, которые расположены на локализованной и делокализованной зоне электронной орбитали[118]. При pH 5—8 доминирует четырёхвалентный плутоний[117], который наиболее устойчив среди остальных валентностей (степеней окисления)[4].
Металлический плутоний получается благодаря реакции его тетрафторида с барием, кальцием или литием при температуре 1200 °C[119]:
Он реагирует с кислотами, кислородом и их парами, но только не с щелочами[58] (в растворах которых заметно не растворяется[7], как и большинство актиноидов[68]). Быстро растворяется в хлороводороде, иодоводороде, бромоводороде, 72 % хлорной кислоте, 85 % ортофосфорной кислоте, концентрированной CCl3COOH, сульфаминовой кислоте и кипящей концентрированной азотной кислоте[101]. Плутоний инертен к концентрированным серной и уксусной кислотам; в их растворах медленно растворяется, то есть реагирует и образует соответствующие соли[10]. При температуре 135 °C металл самовоспламенится благодаря реакции с кислородом, а если его поместить в атмосферу тетрахлорметана, то взорвётся[37].
| Реакционная способность плутония в растворах[13] | |
|---|---|
| Вода | При комнатной температуре реагирует очень медленно, не намного быстрее при температуре кипения; образуется H2 и чёрный порошок Pu(O)ОH |
| NaCl (водн.) | Даёт H2 и чёрный порошок Pu(O)ОH |
| HNO3 | Не реагирует при любых концентрациях из-за пассивации; в присутствии 0,005 М HF кипящая концентрированная кислота сравнительно быстро растворяет плутоний |
| HCl, HBr | Очень быстро растворяется в концентрированных и умеренно разбавленных кислотах |
| HF | Реагирует очень медленно. Брикеты, полученные прессованием стружки металлического плутония, часто растворяются быстро и полностью с образованием нерастворимого PuF3[120] |
| 72%-ая HClO4 | Быстрое растворение |
| H2SO4 | Концентрированная кислота образует на металле защитное покрытие, которое останавливает начавшуюся медленную реакцию. Умеренно разбавленная медленно взаимодействует с металлом; образцы металла, содержащие примеси, могут полностью раствориться в 5 н. кислоте |
| 85%-ая H3PO4 | Реагирует сравнительно быстро |
| Уксусная кислота | Не взаимодействует с ледяной уксусной кислотой, даже с горячей; медленно взаимодействует с разбавленной кислотой |
| Трихлоруксусная кислота | Быстро растворяется в концентрированной кислоте; с разбавленной реагирует медленнее |
| Трифторуксусная кислота | Медленно растворяется в концентрированной кислоте; часто образуется остаток нерастворившегося оксида[121] |
| Сульфаминовая кислота | Довольно быстро растворяется в 1,7 М кислоте, причём температура должна быть ниже 40 °C, чтобы избежать разложения кислоты. Остаётся небольшое количество потенциально пирофорного осадка; в присутствии HNO3 количество осадка больше[122] |
Во влажном кислороде металл быстро окисляется, образуя оксиды и гидриды. Металлический плутоний реагирует с большинством газов при повышенных температурах[101]. Если металл достаточно долго подвергается воздействию малых количеств влажного воздуха, то на его поверхности образуется диоксид плутония. Кроме того, может образоваться и его дигидрид, но только при недостатке кислорода[58]. Ионы плутония во всех степенях окисления склонны к гидролизу и комплексообразованию[59]. Способность образовывать комплексные соединения увеличивается в ряду Pu5+ < Pu6+ < Pu3+ < Pu4+ [5].
При комнатной температуре свежий срез плутония имеет серебристый цвет, который затем тускнеет до серого[51]. Благодаря тому, что поверхность металла становится пассивированной, он становится пирофорным, то есть способным к самовозгоранию, поэтому металлический плутоний, как правило, обрабатывается в инертной атмосфере аргона или азота. Расплавленный металл должен храниться в вакууме, либо в атмосфере инертного газа, чтобы избежать реакции с кислородом[58].
Плутоний обратимо реагирует с чистым водородом, образуя гидрид плутония при температурах 25—50 °C[10][108]. Кроме того, он легко взаимодействует с кислородом, образуя монооксид и диоксид плутония, а также оксиды (но не только их, см. раздел ниже) переменного состава (бертоллиды). Оксиды расширяют плутоний на 40 % от его изначального объёма. Металлический плутоний энергично реагирует с галогеноводородами и галогенами, в соединениях с которыми обычно проявляет степень окисления +3, однако известны галогениды состава PuF4 и PuCl4[10][123]. При реакции с углеродом образует его карбид (PuC), с азотом — нитрид (при 900 °C), с кремнием — силицид (PuSi2)[37][95]. Карбид, нитрид, диоксид плутония имеют температуру плавления больше 2000 °C и потому применяются в качестве ядерного топлива[7].
Тигли, используемые для хранения плутония, должны выдерживать его сильные восстановительные свойства. Тугоплавкие металлы, такие, как тантал и вольфрам, наряду с более стабильными оксидами, боридами, карбидами, нитридами и силицидами, также могут позволить хранить плутоний без реакции с ним. Плавка в электродуговой печи может быть использована для получения малых количеств металла без применения тиглей[58].
Четырёхвалентный церий применяется в качестве химического симулянта плутония(IV)[124].
Электронная структура: 5f-электроны править
Плутоний является элементом, в котором 5f-электроны расположены на границе локализованных и делокализованных электронов, поэтому он считается одним из самых комплексных и трудных элементов для изучения[118]. Аналогично нептунию в высоких степенях окисления (Pu(VI) в виде PuO22+) проявляет способность к проявлению катион-катионных взаимодействий.
Аномальное поведение плутония обусловлено его электронной структурой. Энергетическая разница между 6d и 5f-электронами очень мала. Размеров 5f-оболочки вполне достаточно для того, чтобы они формировали атомную решётку между собой; это происходит на самой границе между локализованными и соединёнными между собой электронами. Близость электронных уровней приводит к формированию низкоэнергетической электронной конфигурации, с примерно одинаковыми уровнями энергии. Это приводит к формированию 5fn7s2 и 5fn−17s26d1 электронных оболочек, что приводит к сложности его химических свойств. 5f-электроны участвуют в формировании ковалентных связей и комплексных соединений у плутония[108].
Нахождение в природе править
Природный плутоний править
Незначительные количества, по крайней мере, двух изотопов плутония (239Pu и 244Pu) найдены в природе[68].
В урановых рудах в результате захвата нейтронов[~ 13] ядрами урана-238 образуется уран-239, который испытывает бета-распад в нептуний-239. В результате следующего β-распада возникает природный плутоний-239. Происходит следующая ядерная реакция[117]:
По этой же реакции плутоний-239 синтезируется в промышленных масштабах (см. изотопы и синтез). Однако в природе плутоний образуется в таких микроскопических количествах (самое большое отношение 239Pu/238U составляет 15⋅10−12), что о его добыче из урановых руд не может быть и речи[117]. В среднем содержание 239Pu примерно в 400 тыс. раз меньше, чем радия[15]. Так, малые количества плутония-239 — триллионная доля — были найдены в урановых рудах[58] в природном ядерном реакторе в Окло, Габон[125]. Отношение плутония к урану, разработка руд которого планируется на 2013 год в шахте Cigar Lake, составляет примерно от 2,4⋅10−12 до 44⋅10−12[126].
Благодаря масс-спектрометрическим измерениям в докембрийском бастнезите[127] было установлено также наличие другого изотопа, плутония-244. Он имеет самый большой среди изотопов плутония период полураспада — примерно 80 млн лет, но, несмотря на это, его содержание меньше, чем плутония-239, поскольку он не образуется в природных реакциях в земной коре, а только распадается. Этот изотоп является примордиальным, то есть дожил до нашего времени со времён, предшествовавших образованию Солнечной системы (4,567 млрд лет назад). За прошедшие 57 периодов полураспада осталась лишь очень небольшая часть от первоначального количества атомов 244Pu, примерно 6,5⋅10−18. Однако повторение эксперимента в 2012 году не привело к положительному результату[128]. Тем не менее, в 2015 году плутоний-244 был обнаружен в метеоритах[129].
Поскольку относительно долгоживущий изотоп плутоний-240 находится в цепочке распада примордиального плутония-244, то он также присутствует в природе, возникая после альфа-распада 244Pu и двух последующих бета-распадов короткоживущих промежуточных ядер. Однако время жизни 240Pu на 4 порядка меньше времени жизни материнского ядра, поэтому и его природное содержание тоже примерно в 104 раз меньше, чем плутония-244.
Очень небольшие количества плутония-238 должны содержаться в урановых рудах[130] как продукт весьма редкого двойного бета-распада урана-238, открытого в 1991 году[131].
Таким образом, в земной коре существует 4 природных изотопа плутония: 238Pu, 239Pu, 240Pu и 244Pu, из которых первые три — радиогенные, а четвёртый присутствует как нуклид межзвёздного происхождения и, возможно, как примордиальный нуклид. Однако экспериментально в природе наблюдались лишь 239Pu и 244Pu. Впервые природный плутоний был выделен в 1948 г. из урановой смоляной руды Г. Т. Сиборгом и М. Перлманом[132].
Техногенный плутоний править
Минимальные количества плутония гипотетически могут находиться в человеческом организме, учитывая, что было проведено около 550 ядерных испытаний, так или иначе связанных с плутонием. Большинство подводных и воздушных ядерных испытаний было прекращено благодаря договору о запрещении ядерных испытаний, который был подписан в 1963 году и ратифицирован СССР, США, Великобританией и другими государствами. Некоторые государства продолжили ядерные испытания.
Именно потому, что плутоний-239 был синтезирован специально для ядерных испытаний, на сегодняшний день он является самым распространённым и часто используемым синтезированным нуклидом из всех изотопов плутония[37].
Изотопы править
Открытие изотопов плутония началось с 1940 года, когда был получен плутоний-238. В настоящее время он считается одним из важнейших нуклидов. Годом позднее был открыт самый важный нуклид — плутоний-239[50], впоследствии нашедший своё применение в ядерной и космической промышленности. Химический элемент является актиноидом, один из его изотопов, который упомянут выше, входит в основную тройку делящихся изотопов[44] (уран-233 и уран-235 являются остальными двумя)[133]. Как и изотопы всех актиноидов, все изотопы плутония являются радиоактивными[134].
Наиболее важные ядерные свойства нуклидов плутония перечислены в таблице:
| Ядерные свойства изотопов плутония[13][135][136][137] | ||||
|---|---|---|---|---|
| Массовое число | Период полураспада | Тип распада | Основное излучение, МэВ (выход, в %) |
Способ получения |
| 228 | 1,1 с | α ≈ 100 % β+ < 0,1 |
7,950 | |
| 229 | > 2⋅10−5 с | α | 7,590 | |
| 230 | 1,7 мин | α ≤ 100 % | 7,175 | |
| 231 | 8,6 мин | β+ ≤ 99,8 % α ≥ 0,2 % |
4,007 |
|
| 232 | 34 мин | ЭЗ ≥ 80 % α ≤ 20 % |
α 6,60 (62 %) 6,54 (38 %) |
233 92U(α,5n) |
| 233 | 20,9 мин | ЭЗ 99,88 % α 0,12 % |
α 6,30 γ 0,235 |
233 92U(α,4n) |
| 234 | 8,8 ч | ЭЗ 94 % α 6 % |
α 6,202 (68 %) 6,151 (32 %) |
235 92U(α,3n) |
| 235 | 25,6 мин | ЭЗ > 99 % α 3⋅10−3 % |
α 5,85 γ 0,049 |
235 92U(α,4n) 233 92U(α,2n) |
| 236 | 2,85 лет 3,5⋅109 лет |
α СД |
α 5,768 (69 %) 5,721 (31 %) |
235 92U(α,3n) Доч. 236 93Np |
| 237 | 45,4 сут | ЭЗ > 99 % α 3,3⋅10−3 % |
α 5,65 (21 %) 5,36 (79 %) |
235 92U(α,2n) 237 93Np(d,2n) |
| 238 | 87,74 лет 4,8⋅1010 лет |
α СД |
α 5,499 (70,9 %) 5,457 (29 %) |
Доч. 242 96Cm Доч. 238 93Np |
| 239 | 2,41⋅104 лет 5,5⋅1015 лет |
α СД |
α 5,155 (73,3 %) 5,143 (15,1 %) γ 0,129 |
Доч. 239 93Np Захват нейтронов |
| 240 | 6,563⋅103 лет 1,34⋅1011 лет |
α СД |
α 5,168 (72,8 %) 5,123 (27,1 %) |
Многократный захват нейтронов |
| 241 | 14,4 года | β− > 99 % α 2,41⋅10−3 % |
α 4,896 (83,2 %) 4,853 (21,1 %) β− 0,021 γ 0,149 |
Многократный захват нейтронов |
| 242 | 3,76⋅105 лет 6,8⋅1010 лет |
α СД |
α 4,901 (74 %) 4,857 (26 %) |
Многократный захват нейтронов |
| 243 | 4,956 ч | β− | β− 0,58 γ 0,084 |
Многократный захват нейтронов |
| 244 | 8,26⋅107 лет 6,6⋅1010 лет |
α СД |
α 4,589 (81 %) 4,546 (19 %) |
Многократный захват нейтронов |
| 245 | 10,5 ч | β− | β− 1,28 γ 0,327 |
244 94Pu(n,γ) |
| 246 | 10,85 сут | β− | β− 0,384 γ 0,224 |
245 94Pu(n,γ) |
Из изотопов плутония на данный момент известно о существовании его 19 нуклидов с массовыми числами 228—247[137]. Только 4 из них нашли своё применение[15]. Свойства изотопов имеют некоторую характерную особенность, по которой можно судить об их дальнейшем изучении — чётные изотопы имеют бо́льшие периоды полураспада, чем нечётные (однако данное предположение относится только к менее важным его нуклидам).
Министерство энергетики США делит смеси плутония на три вида[138]:
- оружейный плутоний (содержание 240Pu в 239Pu менее 7 %)
- топливный плутоний (от 7 до 18 % 240Pu) и
- реакторный плутоний (содержание 240Pu более 18 %)
Термин «сверхчистый плутоний» используется для описания смеси изотопов плутония, в которых содержатся 2—3 процента 240Pu[138].
Всего два изотопа этого элемента (239Pu и 241Pu) являются более способными к ядерному делению, нежели остальные; более того, это единственные изотопы, которые подвергаются ядерному делению при действии тепловых нейтронов[138]. Среди продуктов взрыва термоядерных бомб обнаружены также 247Рu и 255Рu[4], периоды полураспада которых несоизмеримо малы.
Изотопы и синтез править
Известны около 20 изотопов плутония, все они радиоактивны. Самым долгоживущим из них является плутоний-244, с периодом полураспада 80,8 млн лет; плутоний-242 имеет более короткий период полураспада — 372 300 лет; плутоний-239 — 24 110 лет. Все остальные изотопы имеют период полураспада меньше 7 тыс. лет. Этот элемент имеет 8 метастабильных состояний, периоды полураспада этих изомеров не превышают 1 с[106].
Массовое число известных изотопов элемента варьируется от 228 до 247. Все они испытывают один или несколько типов радиоактивного распада:
- электронный захват (и, при достаточной энергии, позитронный бета-распад) с образованием изотопов нептуния;
- бета-минус-распад с образованием изотопов америция;
- альфа-распад с образованием изотопов урана;
- спонтанное деление с образованием широкого спектра дочерних изотопов элементов из средней части периодической таблицы, многие из которых β−-активны.
Основным каналом распада наиболее лёгких изотопов плутония (с 228 по 231) является альфа-распад, хотя канал электронного захвата для них также открыт. Основным каналом распада лёгких изотопов плутония (с 232 по 235 включительно) является электронный захват, с ним конкурирует альфа-распад. Основными каналами радиоактивного распада изотопов с массовыми числами между 236 и 244 (кроме 237[139], 241[139] и 243) являются альфа-распад и (с меньшей вероятностью) спонтанное деление. Основным каналом распада изотопов плутония, массовые числа которых превосходят 244 (а также 243Pu и 241Pu), является бета-минус-распад в изотопы америция (95 протонов). Плутоний-241 является членом «вымершего» радиоактивного ряда нептуния[51][106].
Бета-стабильными (то есть испытывающими лишь распады с изменением массового числа) являются изотопы с массовыми числами 236, 238, 239, 240, 242 и 244.
Синтез плутония править
Плутоний в промышленных масштабах получается двумя путями[138]:
- облучением урана (см. реакцию ниже), содержащегося в ядерных реакторах;
- облучением в реакторах трансурановых элементов, выделенных из отработанного топлива.
После облучения в обоих случаях выполняется отделение химическими способами плутония от урана, трансурановых элементов и продуктов деления.
Плутоний-238 править
Плутоний-238, использующийся в радиоизотопных генераторах энергии, лабораторно может синтезироваться в обменной (d, 2n)-реакции на уране-238:
В данном процессе дейтрон попадает в ядро урана-238, в результате чего образуется нептуний-238 и два нейтрона. Далее нептуний-238 испытывает бета-минус-распад в плутоний-238. Именно в этой реакции был впервые получен плутоний (1941, Сиборг). Однако она неэкономична. В промышленности плутоний-238 получают двумя путями:
- выделением из облучённого ядерного топлива (в смеси с другими изотопами плутония, разделение которых очень дорого), поэтому чистый плутоний-238 таким методом не нарабатывается
- с помощью нейтронного облучения в реакторах нептуния-237.
Цена одного килограмма плутония-238 составляет примерно 1 млн долларов США[140].
Плутоний-239 править
Плутоний-239, делящийся изотоп, используемый в ядерном оружии и в ядерной энергетике, промышленно синтезируется[10] в ядерных реакторах (в том числе в энергетических как побочный продукт) с помощью следующей реакции при участии ядер урана и нейтронов с помощью бета-минус-распада и с участием изотопов нептуния как промежуточного продукта распада[141]:
Нейтроны, излучаемые при делении урана-235, захватываются ураном-238 с образованием урана-239; затем через цепочку двух β−-распадов образуются нептуний-239 и далее плутоний-239[142]. Сотрудники засекреченной британской группы Tube Alloys, которые занимались изучением плутония во время Второй мировой войны, предсказали существование данной реакции в 1940 г.
Тяжёлые изотопы плутония править
Более тяжёлые изотопы нарабатываются в реакторах из 239Pu по цепочке последовательных нейтронных захватов, каждый из которых увеличивает массовое число нуклида на единицу.
Свойства некоторых изотопов править
Изотопы плутония претерпевают радиоактивный распад, вследствие которого выделяется тепловая энергия. Разные изотопы излучают разное количество тепла. Тепловыделение обычно записывается в пересчёте на Вт/кг или мВт/кг. В случаях, когда плутоний присутствует в больших количествах и нет теплоотвода, тепловая энергия может расплавить содержащий плутоний материал.
Все изотопы плутония способны к ядерному делению (при воздействии нейтрона)[143] и излучают γ-частицы.
| Выделение тепла изотопами плутония[144] | |||||
|---|---|---|---|---|---|
| Изотоп | Тип распада | Период полураспада (в годах) |
Тепловыделение (Вт/кг) |
Спонтанное деление нейтроны (1/(г·с)) |
Комментарий |
| 238Pu | альфа в 234U | 87,74 | 560 | 2600 | Очень высокая температура распада. Даже в небольших количествах может привести к саморазогреву. Используется в РИТЭГ. |
| 239Pu | альфа в 235U | 24100 | 1,9 | 0,022 | Основной ядерный продукт. |
| 240Pu | альфа в 236U, спонтанное деление | 6560 | 6,8 | 910 | Является основной примесью в плутонии-239. Высокий показатель спонтанного деления не позволяет использовать плутоний для изготовления ядерного оружия при содержании Pu-240 более 6-7%. |
| 241Pu | бета в 241Am | 14,4 | 4,2 | 0,049 | Распадается до америция-241; его накопление приводит к высокому тепловыделению (так называемое старение оружейного плутония). |
| 242Pu | альфа в 238U | 376000 | 0,1 | 1700 | — |
| Критические массы некоторых изотопов актиноидов | |||
|---|---|---|---|
| Нуклид | Критическая масса, кг | Диаметр, см | Источник |
| Уран-233 | 15 | 11 | [145] |
| Уран-235 | 52 | 17 | [145] |
| Нептуний-236 | 7 | 8,7 | [146] |
| Нептуний-237 | 60 | 18 | [147] |
| Плутоний-238 | 9,04—10,07 | 9,5—9,9 | [148] |
| Плутоний-239 | 10 | 9,9 | [145][148] |
| Плутоний-240 | 40 | 15 | [145] |
| Плутоний-241 | 12 | 10,5 | [149] |
| Плутоний-242 | 75—100 | 19—21 | [149] |
Плутоний-236 был найден в плутониевой фракции, полученной из природного урана, при измерении радиоизлучения которой наблюдался пробег α-частиц, равный 4,35 см (что соответствует 5,75 МэВ). Было установлено, что данная группа относилась к изотопу 236Pu, образующемуся благодаря реакции 235U(α,3n)236Pu. Позднее было обнаружено, что возможны такие реакции, как: 237Np(a, p4n)236Pu; 237Np(α,5n)236Am → (ЭЗ) 236Pu. В настоящее время его получают благодаря взаимодействию дейтрона с ядром урана-235. Изотоп образуется благодаря α-излучателю 240
96Cm (T½ 27 сут) и β-излучателя 236
93Np (T½ 22 ч). Плутоний-236 является альфа-излучателем, способным к спонтанному делению. Скорость самопроизвольного деления составляет 5,8⋅107 делений на 1 г/ч, что соответствует периоду полураспада для этого процесса — 3,5⋅109 лет[35].
Плутоний-238 имеет интенсивность самопроизвольного деления 1,1⋅106 делений/(с·кг), что в 2,6 раза больше 240Pu, и очень высокую тепловую мощность: 567 Вт/кг. Изотоп обладает очень сильным альфа-излучением (при воздействии на него нейтронов[51]), которое в 283 раза сильнее 239Pu, что делает его более серьёзным источником нейтронов при реакции α → n. Содержание плутония-238 редко когда превышает 1 % от общего состава плутония, однако излучение нейтронов и нагрев делают его очень неудобным для обращения[150]. Его удельная радиоактивность составляет 17,1 Ки/г[151].
Плутоний-239 имеет большие сечения рассеивания и поглощения, чем уран, и большее число нейтронов в расчёте на одно деление, и меньшую критическую массу[150], которая составляет 10 кг в альфа-фазе[144]. При ядерном распаде плутония-239 посредством воздействия на него нейтронами этот нуклид распадается на два осколка (примерно равные между собой более лёгкие атомы), выделяя примерно 200 МэВ энергии. Это приблизительно в 50 млн раз больше выделяемой при горении энергии (C+O2 → CO2↑). «Сгорая» в ядерном реакторе, изотоп выделяет 2⋅107 ккал[15]. Чистый 239Pu имеет среднюю величину испускания нейтронов от спонтанного деления примерно 30 нейтронов/с·кг (примерно 10 делений в секунду на килограмм). Тепловая мощность составляет 1,92 Вт/кг (для сравнения: теплота обмена веществ у взрослого человека составляет меньшую тепловую мощность), что делает его тёплым на ощупь. Удельная активность равна 61,5 мКи/г[150].
Плутоний-240 является основным изотопом, загрязняющим оружейный 239Pu. Уровень его содержания главным образом важен из-за интенсивности спонтанного деления, которая составляет 415 000 делений/с·кг, но испускается примерно 1⋅106 нейтронов/(с·кг), так как каждое деление рождает приблизительно 2,2 нейтрона, что примерно в 30 000 раз больше, чем у 239Pu. Плутоний-240 хорошо делится, чуть лучше, чем 235U. Тепловой выход больше, чем у плутония-239 и составляет 7,1 Вт/кг, что обостряет проблему перегрева. Удельная активность равна 227 мКи/г[150].
Плутоний-241 имеет низкий нейтронный фон и умеренную тепловую мощность и потому непосредственно не влияет на удобство применения плутония (Тепловая мощность равна 3,4 Вт/кг). Однако он с периодом полураспада 14 лет превращается в америций-241, который плохо делится и обладает большой тепловой мощностью, ухудшая качество оружейного плутония. Таким образом, плутоний-241 влияет на старение оружейного плутония. Удельная активность — 106 Ки/г[150].
Интенсивность испускания нейтронов плутония-242 составляет 840 000 делений/(с·кг) (вдвое выше 240Pu), плохо подвержен ядерному делению. При заметной концентрации серьёзно увеличивает требуемую критическую массу и нейтронный фон. Имея большую продолжительность жизни и маленькое сечение захвата, нуклид накапливается в переработанном реакторном топливе. Удельная активность составляет 4 мКи/г[150].
Сплавы править
Сплавы плутония, или интерметаллические соединения, обычно получают прямым взаимодействием элементов в нужных отношениях[13]. В большинстве случаев для получения гомогенного вещества применяют дуговую плавку; иногда нестабильные сплавы можно получить распылительным осаждением[152][153] или охлаждением расплавов[154].
| δ-Стабилизаторы[13] | |||||
|---|---|---|---|---|---|
| Группа | Растворённый металл |
Разница в размерах, % |
Минимальное количество растворённого металла, необходимое для стабилизации δ-фазы, % | ||
| IIIA | Sc Lu Tm Er Dy Ce |
−0,2 +5,5 +6,2 +6,9 +7,8 +4,3 |
2,75±0,25 4,1±0,3 <5 4,1±0,3 4,1±0,3 5[~ 14] | ||
| IIIB | Ga Al In Tl |
−14,2 −12,9 +1,2 +4,4 |
2[~ 15] 1[~ 16] 1±0,2 3,6±0,5 4,4±0,6 | ||
| IVA | Hf Zr |
−3,9 −2,6 |
4,6±0,5 7,0±0,5 | ||
Легированные алюминием, галлием или железом, сплавы плутония имеют промышленное значение[1].
Плутоний может образовывать сплавы и промежуточные соединения с большинством металлов. Исключениями являются литий, натрий, калий и рубидий из щелочных металлов; магний, кальций, стронций и барий из щёлочноземельных металлов; европий и иттербий из РЗЭ[58]. Частичными исключениями являются тугоплавкие металлы: хром, молибден, ниобий, тантал и вольфрам, которые растворимы в жидком плутонии, но почти нерастворимые или малорастворимые в твёрдом плутонии[58]. Галлий, алюминий, америций, скандий и церий могут стабилизировать δ-плутоний при комнатной температуре. Кремний, индий, цинк и цирконий способны к формированию метастабильного δ-плутония (δ'-фаза) при быстром охлаждении. Большие количества гафния, гольмия и таллия иногда позволяют сохранить некоторое количество δ-плутония при комнатной температуре. Нептуний является единственным элементом, который может стабилизировать α-плутоний при высоких температурах. Титан, гафний и цирконий стабилизируют структуру β-плутония при комнатной температуре при резком охлаждении[108].
Сплавы плутония могут быть получены при добавлении металла в расплавленный плутоний. Если легирующий металл является достаточно сильным восстановителем, то в этом случае плутоний используется в виде оксидов или галогенидов. Сплавы δ-плутоний-галлий и плутоний-алюминий получают путём добавления фторида плутония(III) в расплавленный галлий или алюминий, который имеет особенность, заключающуюся в том, что алюминий не реагирует с высокоактивным плутонием[155].
Виды сплавов править
- Плутоний-галлий — сплав, использующийся для стабилизации δ-фазы плутония, который позволяет избежать переход α—δ фаза[105].
- Плутоний-алюминий — альтернативный сплав, по своим свойствам аналогичен сплаву Pu-Ga. Данный сплав может быть использован в качестве компонента ядерного топлива[156].
- Плутоний-галлий-кобальт (PuGaCo5) — сверхпроводниковый сплав при температуре, составляющей 18,5 К. Необычно высокая температура перехода может свидетельствовать о том, что вещества на основе плутония представляют собой новый класс сверхпроводников[118][157][14].
- Плутоний-цирконий — сплав, который иногда может быть использован в качестве ядерного топлива[158].
- Плутоний-церий и плутоний-церий-кобальт — сплавы, используемые в качестве ядерного топлива[159].
- Плутоний-уран — сплав, содержание плутония в котором примерно равно 15—30 молей в процентном содержании. Используется в ядерных реакторах, работающих на быстрых нейтронах. Сплав имеет пирофорный характер, высокую восприимчивость к коррозии при достижении точки самовоспламенения, или способен к разложению при воздействии на него кислородом. Данный сплав требует легирования с другими металлами. Добавление алюминия, углерода или меди не сможет существенно улучшить свойства сплава; добавление циркония или сплавов железа повысят коррозионную стойкость данного сплава, однако после нескольких месяцев воздействия воздуха на легированный сплав данные качества теряются. Добавление титана и/или циркония позволит существенно повысить температуру плавления сплава[160].
- Плутоний-уран-титан и плутоний-уран-цирконий — сплав, исследование которого предполагало его использование в качестве ядерного топлива. Добавление третьего элемента (титан и/или цирконий) в эти сплавы позволит улучшить устойчивость к коррозии, снизить возможность воспламенения, повысить пластичность, технологичность, прочность и тепловое расширение. Сплав плутоний-уран-молибден имеет наилучшую устойчивость к коррозии, так как образует на своей поверхности оксидную плёнку[160].
- Сплав торий-уран-плутоний был исследован в качестве топлива для ядерных реакторов, работающих на быстрых нейтронах[160].
Меры предосторожности править
Токсичность править
Плутоний, в зависимости от изотопного состава, обладает высокой и особо высокой радиотоксичностью[161]. Данные свойства проявляются как следствие α-излучения, так как зачастую приходится работать с α-активными изотопами (например, 239Pu). Альфа-частицы представляют серьёзную опасность в том случае, если их источник находится в теле заражённого. При этом они повреждают окружающие элементы ткани организма. Хотя плутоний способен излучать γ-лучи и нейтроны, которые могут проникать в тело снаружи, их уровень слишком мал для того, чтобы причинить вред здоровью. Разные изотопы плутония обладают разной токсичностью, например, типичный реакторный плутоний в 8—10 раз токсичнее чистого 239Pu, так как в нём преобладают нуклиды 240Pu, который является мощным источником альфа-излучения[35].
Плутоний самый радиотоксичный элемент из всех актиноидов[162], однако считается отнюдь не самым опасным элементом. Если принять радиологическую токсичность 238U за единицу, этот же показатель для плутония и некоторых других элементов образует ряд:
из которого следует вывод, что радий почти в тысячу раз опаснее изотопа плутония 239Pu[35][58].
При ингаляции плутоний обладает канцерогенными свойствами и способен вызвать рак лёгкого. Однако следует помнить, что при попадании с пищей 14C и 40K гораздо более канцерогенны. Тем не менее, сам по себе плутоний крайне токсичен, так как имеет свойство концентрироваться в кроветворных участках костей и может вызвать заболевания через много лет после его попадания[35].
Альфа-частицы обладают относительно малой проникающей способностью: для 239Pu пробег α-частиц в воздухе составляет 3,7 см, а в мягкой биологической ткани — 43 мкм. В совокупности с высокой полной ионизацией (1,47⋅107 пар ионов на одну α-частицу) небольшая величина пробега обуславливает значительную величину плотности ионизации; а чем выше её плотность, тем выше воздействие на организм. В связи с тем, что α-излучение приводит к необратимым изменениям в скелете, печени, селезёнке и почках, все изотопы элемента относят к группе элементов с особо высокой радиотоксичностью (группа A токсичности). Эти изменения трудно диагностировать; они не проявляются настолько быстро, что можно констатировать о нахождении элемента в организме[35]. Несмотря на малую проникающую способность, плутоний-239 в условиях эксперимента оказался способен вызывать хромосомные мутации и микроядра в клетках растений при контакте с живой тканью[163]. Плутоний-238 в эксперименте по воздействию на клетки китайского хомяка оказался способен повышать частоту хромосомных аберраций и сестринских хроматидных обменов при дозе в 0,5 рад (0,005 грей)[164]
Плутоний склонен к образованию аэрозолей[20]. Хотя плутоний и является металлом, он очень летуч[35]. Например, достаточно пронести его образец по комнате, чтобы допустимое содержание элемента в воздухе было превышено. Поэтому в процессе дыхания он склонен проникать в лёгкие и бронхи. Значимы два типа воздействия: острое и хроническое отравление. Если уровень облучения достаточно высок, ткани могут страдать острым отравлением, и токсическое воздействие проявляется очень быстро. Если уровень облучения мал, то образуется накопляющийся канцерогенный эффект[35].
Попавшее количество элемента определяется коэффициентом всасывания, составляющим K = 1⋅10−3. Для биологически связанного элемента коэффициент выше: K = 1⋅10−2, причём коэффициент всасывания возрастает в 10—100 раз для детей по сравнению к взрослым. Плутоний может попадать в организм через раны и ссадины, путём вдыхания или заглатывания. Однако наиболее опасным путём попадания в организм является поглощение из лёгких[35].
Попавший в лёгкие плутоний частично оседает на поверхности лёгких, частично переходит в кровь, а затем в лимфоузлы и костный мозг. Примерно 60 % попадает в костную ткань, 30 % в печень и 10 % выводится естественным путём. Количество попавшего в организм плутония зависит от величины аэрозольных частиц и растворимости в крови[35].
Плутоний очень плохо всасывается через желудочно-кишечный тракт. Плутоний в четырёхвалентном состоянии в течение нескольких суток на 70—80 % отлагается в печени человека и на 10—15 % в костных тканях. Попавший в организм элемент менее ядовит, чем такие известные яды, как цианид или стрихнин. Поглощение всего 0,5 г плутония привело бы к смерти за несколько дней или недель за счёт острого облучения пищеварительной системы (для цианида это значение составляет 0,1 г). Вдыхание 0,1 г плутония в виде частиц оптимального размера для удержания в лёгких приведёт к смерти из-за отёка лёгких за 1—10 дней. Вдыхание 0,2 г приведёт к смерти от фиброза за один месяц. Для намного меньших величин, попавших в организм, возникает высокий риск появления хронического канцерогенного эффекта[35].
Самой вероятной формой попадания плутония в организм является его практически не растворимый в воде диоксид. Он применяется на АЭС в качестве источника электроэнергии[35]. Следовательно, плутоний, из-за нерастворимости его оксида, имеет большие показатели полувыведения из организма[162].
В природе плутоний чаще всего находится в четырёхвалентном состоянии, которое по своим химическим свойствам напоминает трёхвалентное железо (Fe3+. Если он проникает в систему кровообращения, то с большой вероятностью начнёт концентрироваться в тканях, содержащих железо: костный мозг, печень, селезёнка. Организм путает плутоний с железом, следовательно, белок трансферина забирает плутоний вместо железа, в результате чего останавливается перенос кислорода в организме. Микрофаги разносят плутоний по лимфоузлам. Если 0,14 г разместятся в костях взрослого человека, то риск ухудшения иммунитета будет очень велик, и через несколько лет может развиться рак[35]. Проведённые исследования элемента на токсичность показали, что для человека весом 70 кг смертельная доза составляет 0,22 г[162].
Попавший в организм плутоний выводится из него очень долго — на протяжении 50 лет из организма выведется около 80 %. Период биологического полувыведения из костной ткани составляет 80—100 лет[35]. Получается, что его концентрация в костях живого человека практически постоянна[59]. Период полувыведения из печени составляет 40 лет. Максимально безопасным значением количества плутония в организме для 239Pu составляет 0,047 мкКи, что эквивалентно 0,0075 г. Молоко выводит плутоний в 2—10 раз активнее воды[35].
Критическая масса править
Этот раздел не завершён. |
Критическая масса — минимальная масса делящегося вещества, при которой в нём может происходить самоподдерживающаяся ядерная реакция деления. Если масса вещества ниже критической, то слишком много нейтронов, необходимых для реакции деления, теряется, и цепная реакция не идёт. При массе больше критической цепная реакция может лавинообразно ускоряться, что приводит к ядерному взрыву.
Критическая масса зависит от размеров и формы делящегося образца, так как они определяют утечку нейтронов из образца через его поверхность. Минимальную критическую массу имеет образец сферической формы, так как площадь его поверхности наименьшая. Критическая масса чистого металлического плутония-239 сферической формы 11 кг (диаметр такого шара 10 см), чистого урана-235 — 47 кг (диаметр шара 17 см)[165]. Отражатели и замедлители нейтронов, окружающие делящееся вещество, могут существенно снизить критическую массу[165]. Критическая масса также зависит от химического состава образца и его плотности.
Самовоспламенение править
В мелкодисперсном состоянии плутоний, как и все актиноиды, проявляет пирофорные свойства[68]. Во влажной среде на поверхности плутония образуются гидриды переменного состава; реагируя с кислородом, плутоний воспламеняется даже при комнатной температуре. В результате окисления плутоний расширяется на 70 % и может повредить содержащий его контейнер[166]. Радиоактивность плутония является препятствием для тушения. Песок из оксида магния наиболее эффективный материал для тушения: он охлаждает плутоний, а также блокирует доступ кислорода. Плутоний следует хранить либо в атмосфере инертного газа[166], либо при наличии циркулирующего воздуха (учитывая, что 100 г плутония-239 выделяют 0,2 Вт тепла)[68]. Элемент имеет исключительно высокую пирофорность при нагреве до 470—520 °C[1].
Методы отделения править
Этот раздел не завершён. |
Обобщённое представление о способах отделения плутония от примесей, предшествующих элементов и их продуктов деления состоит из трёх стадий. В первой стадии отработавшие тепловыделяющие сборки демонтируются, и оболочка, содержащая отработавший плутоний и уран, удаляется физическими и химическими способами. На втором этапе извлечённое ядерное топливо растворяют в азотной кислоте. На третьем и самом комплексном этапе отделения плутония от других актинидов и продуктов деления применяют технологию, известную как «solvent process» (с англ. — «экстракция растворителем»). Трибутилфосфат обычно используется в качестве экстрагента в керосиноподобном растворителе в пьюрекс-процессе. Как правило, очищение плутония и урана происходит в несколько этапов для достижения необходимой чистоты элементов[138]. Первоначально вышеупомянутый процесс был создан для переработки ядерного топлива реакторов, созданных для военных целей. Позднее эту технологию удалось применять и на энергетических реакторах[13].
Применение править
Металлический плутоний используется в ядерном оружии и служит в качестве ядерного топлива. Оксиды плутония используются в качестве энергетического источника для космической техники и находят своё применение в ТВЭЛах[105]. Плутоний используется в элементах питания космических аппаратов[167]. Ядра плутония-239 способны к цепной ядерной реакции при воздействии на них нейтронов, поэтому этот изотоп можно использовать как источник атомной энергии (энергия, освобождающаяся при расщеплении 1 г 239Pu, эквивалентна теплоте, выделяющейся при сгорании 4000 кг угля)[59]. Более частое использование плутония-239 в ядерных бомбах обусловлено тем, что плутоний занимает меньший объём в сфере (где расположено ядро бомбы), следовательно, можно выиграть во взрывной силе бомбы за счёт этого свойства. Ядро плутония при ядерной реакции испускает в среднем около 2,895 нейтрона против 2,452 нейтрона у урана-235. Однако затраты на производство плутония примерно в шесть раз больше по сравнению с ураном-235[112].
Изотопы плутония нашли своё применение при синтезе трансплутониевых (последующих после плутония) элементов[4]. Таким образом, смешанный оксид плутония-242 в 2009 г. и бомбардировки ионами кальция-48 в 2010 году того же изотопа были использованы для получения флеровия[168][169][170]. В Оук-Риджской национальной лаборатории длительное нейтронное облучение 239Pu используется для получения 244
96Cm (в количестве 100 г), 242
96Cm, 249
97Bk, 252
98Cf и 253
99Es (в миллиграммовых количествах) и 257
100Fm (в микрограммовых количествах). За исключением 239Pu, все оставшиеся трансурановые элементы производились в прошлом в исследовательских целях[68]. Благодаря нейтронному захвату изотопов плутония в 1944 году Г. Т. Сиборгом и его группой был получен первый изотоп америция — 241
95Am[117] (реакция 239Pu(2n, e)241Am)[37]. Для подтверждения того, что актиноидов всего 14 (по аналогии с лантаноидами) был произведён в 1966 году в Дубне синтез ядер резерфордия (в то время курчатовия) под руководством академика Г. Н. Флёрова[171][172]:
δ-Стабилизированные сплавы плутония применяются при изготовлении топливных элементов, так как они обладают лучшими металлургическими свойствами по сравнению с чистым плутонием, который при нагревании претерпевает фазовые переходы[13].
«Сверхчистый» плутоний (смесь изотопов плутония, содержание в которой не превышает 2—3 % 240Pu) используется в ядерном оружии ВМФ США и применяется на кораблях и подводных лодках под ядерной защитой из свинца, что снижает дозовую нагрузку на команду[173].
Плутоний-238 и плутоний-239 являются самыми широко синтезируемыми изотопами[51].
- Первый ядерный заряд на основе плутония был взорван 16 июля 1945 года на полигоне Аламогордо (испытание под кодовым названием «Тринити»).
Ядерное оружие править
Плутоний очень часто применялся в ядерных бомбах. Бомба, сброшенная в 1945 году на Нагасаки, содержала в себе 6,2 кг плутония. Мощность взрыва составила 21 килотонну (взрыв оказался на 40 % больше, по сравнению с бомбардировкой Хиросимы)[174]. К концу 1945 года погибло 60—80 тыс. человек[175]. По истечении 5 лет, общее количество погибших, с учётом умерших от рака и других долгосрочных воздействий взрыва, могло достичь или даже превысить 140 000 человек[174].
Принцип, по которому происходил ядерный взрыв с участием плутония, заключался в конструкции ядерной бомбы. «Ядро» бомбы состояло из сферы, наполненной плутонием-239, которая в момент столкновения с землёй сжималась до миллиона атмосфер за счёт конструкции[112] и благодаря окружающему эту сферу взрывчатому веществу[176]. После удара ядро расширялось в объёме и в плотности за десяток микросекунд, при этом сжимаемая сборка проскакивала критическое состояние на тепловых нейтронах и становилась существенно сверхкритической на быстрых нейтронах, то есть начиналась цепная ядерная реакция с участием нейтронов и ядер элемента[177]. При этом следовало учитывать, что бомба не должна была взорваться преждевременно. Однако это практически невозможно, так как, чтобы сжать плутониевый шар за десяток наносекунд всего на 1 см, требуется придать веществу ускорение, в десятки триллионов раз превышающее ускорение свободного падения. При конечном взрыве ядерной бомбы температура повышается до десятков миллионов градусов[112]. В наше время для создания полноценного ядерного заряда достаточно 8—9 кг этого элемента[178].
Всего один килограмм плутония-239 может произвести взрыв, который будет эквивалентен 20 000 т тротила[51]. Даже 50 г элемента при делении всех ядер произведут взрыв, равный детонации 1000 т тротила[179]. Данный изотоп является единственным подходящим нуклидом для применения в ядерном оружии, так как присутствие хотя бы 1 % 240Pu приведёт к образованию большого количества нейтронов, которые не позволят эффективно применять пушечную схему заряда ядерной бомбы. Остальные изотопы рассматриваются только из-за их вредного действия[150].
Плутоний-240 может находиться в ядерной бомбе в малых количествах, однако если его содержание будет повышено, произойдёт преждевременная цепная реакция. Данный изотоп имеет высокую вероятность спонтанного деления (примерно 440 делений в секунду на грамм; высвобождается примерно 1000 нейтронов в секунду на грамм[180]), что делает невозможным большой процент его содержания в делящемся материале[75].
По данным телеканала Al-Jazeera, Израиль имеет около 118 боеголовок с плутонием в качестве радиоактивного вещества[181]. Считается, что Южная Корея имеет около 40 кг плутония, количества которого достаточно для производства 6 ядерных зарядов[182]. По оценкам МАГАТЭ в 2007 году, производимого в Иране плутония хватало на две ядерные боеголовки в год[183]. В 2006 г. Пакистан начал строительство ядерного реактора, который позволит нарабатывать около 200 кг радиоактивного элемента в год. В пересчёте на количество ядерных боеголовок, эта цифра будет составлять приблизительно 40—50 бомб[184].
В 1999 между США и Казахстаном было подписано соглашение о закрытии промышленного ядерного реактора БН-350 в городе Актау, который вырабатывал электроэнергию за счёт плутония[185]. Этот реактор был первым в мире и Казахстане опытно-промышленным реактором на быстрых нейтронах; срок его работы составил 27 лет[186].
Договор с США по ликвидации плутония править
Между Россией и США на протяжении 2000-х годов было подписано несколько договоров, касающихся плутония. В 2003 г., в рамках российско-американской программы по переработке 68 т (по 34 т с каждой стороны) плутония в MOX-топливо до 2024 года, США выделили 200 миллионов долларов на строительство в Северске завода по такой переработке оружейного плутония[22]. В 2007 г. страны подписали план об утилизации Россией 34 т плутония, созданного для российских оружейных программ[178][187]. В 2010 году был подписан протокол к договору об утилизации плутония, количества которого хватило бы на производство 17 тыс. ядерных боеголовок[188].
3 октября 2016 года Россия приостановила договор с США по ликвидации плутония по причине неспособности обеспечить выполнение обязательств американской стороной. Соглашение об утилизации плутония" (Plutonium Management and Disposition Agreement) между двумя странами было подписано 29 августа 2000 года и ратифицировано в 2011 году[189][190]. Согласно договорённостям, оружейный плутоний должен был перерабатываться в оксидное топливо для использования в ядерных реакторах, а также переводиться в формы, непригодные для создания вооружений. Каждая из сторон брала обязательства по утилизации 34 тонн запасов плутония, по последним оценкам, процесс уничтожения мог бы начаться в 2018 году. Условиями возобновления программы указано множество маловероятных событий[191]: отмена Вашингтоном всех антироссийских санкций, компенсаций ущерба, полученного в результате введений антироссийских и контрсанкций, сокращение военного присутствия США в странах НАТО. Соответствующий указ подписан 3 октября 2016 года президентом России Владимиром Путиным[192].
Ядерное загрязнение править
Этот раздел не завершён. |
В период, когда начинались ядерные испытания (1945—1963 гг.) в основе которых лежал плутоний, и когда его радиоактивные свойства только начинали изучаться, в атмосферу было выброшено свыше 5 т элемента[162]. С 1970-х годов доля плутония в радиоактивном заражении атмосферы Земли начала возрастать[1].
В северо-западную часть Тихого океана плутоний попал в основном благодаря ядерным испытаниям. Повышенное содержание элемента объясняется проведением США ядерных испытаний на территории Маршалловых Островов в Тихоокеанском полигоне в 1950-х годах. Основное загрязнение от этих испытаний пришлось на 1960 год. Исходя из оценки учёных, нахождение плутония в Тихом океане повышено по сравнению с общим распространением ядерных материалов на земле[193]. По некоторым расчётам, доза облучения, исходящего от цезия-137, на атоллах Маршалловых островов составляет примерно 95 %, а на остальные 5 приходятся изотопы стронция, америция и плутония[194].
Плутоний в океане переносится благодаря физическим и биогеохимическим процессам. Время нахождения плутония в поверхностных водах океана составляет от 6 до 21 года, что, как правило, короче, чем у цезия-137. В отличие от этого изотопа, плутоний является элементом, частично реагирующим с окружающей средой и образующим 1—10 % нерастворимых соединений от общей массы, попавшей в окружающую среду (у цезия это значение составляет менее 0,1 %). Плутоний в океане выпадает на дно вместе с биогенными частицами, из которых он восстанавливается в растворимые формы в результате микробного разложения. Наиболее распространёнными из его изотопов в морской среде являются плутоний-239 и плутоний-240[193].
В январе 1968 года американский самолёт B-52 с четырьмя зарядами ядерного оружия в результате неуспешной посадки разбился на льду вблизи Туле, на территории Гренландии. Столкновение вызвало взрыв и фрагментацию оружия, в результате чего плутоний попал на льдину. После взрыва верхний слой загрязнённого снега была снесён, и в результате образовалась трещина, через которую плутоний попал в воду[195]. Для уменьшения урона природе было собрано примерно 1,9 млрд литров снега и льда, которые могли подвергнуться радиоактивному загрязнению. В 2008 году было высказано предположение, что один из четырёх зарядов так и не был найден[196], однако Датский институт международных отношений в отчёте, подготовленном по поручению министра иностранных дел Дании Пер Стиг Меллер, пришёл к выводу, что существуют неопровержимые доказательства того, что ни одна из бомб не могла остаться в рабочем или хотя бы более или менее сохранном состоянии, а утверждения об утерянной бомбе лишены фактических оснований. В качестве наиболее вероятной цели подводного поиска называется урановый сердечник второй ступени одной из бомб[197].
Известен случай, когда советский космический аппарат Космос-954 24 января 1978 года с ядерным источником энергии на борту при неконтролируемом сходе с орбиты упал на территорию Канады. Данное происшествие привело к попаданию в окружающую среду 1 кг плутония-238 на площадь около 124 000 м²[198][199].
Попадание плутония в окружающую среду связано не только с техногенными происшествиями. Известны случаи утечки плутония как из лабораторных, так и из заводских условий. Было около 22 аварийных случаев утечки из лабораторий урана-235 и плутония-239. На протяжении 1953—1978 гг. аварийные случаи привели к потере от 0,81 (Маяк, 15 марта 1953 г.) до 10,1 кг (Томск, 13 декабря 1978 г.) 239Pu. Происшествия на промышленных предприятиях суммарно привели к смерти двух человек в г. Лос-Аламос (21.08.1945 и 21.05.1946) из-за двух случаев аварий и потерь 6,2 кг плутония. В городе Саров в 1953 и 1963 гг. примерно 8 и 17,35 кг попало за пределы ядерного реактора. Один из них привёл к разрушению ядерного реактора в 1953 году[200].
Известен случай аварии на Чернобыльской АЭС, который произошёл 26 апреля 1986 года. В результате разрушения четвёртого энергоблока в окружающую среду было выброшено 190 т радиоактивных веществ на площадь около 2200 км². Восемь из 140 т радиоактивного топлива реактора оказались в воздухе. Загрязнённая площадь составила 160 000 км²[201]. Для ликвидации последствий были мобилизованы значительные ресурсы, более 600 тыс. человек участвовали в ликвидации последствий аварии. Суммарная активность веществ, выброшенных в окружающую среду, составила, по различным оценкам, до 14⋅1018 Бк (или 14 ЭБк), в том числе[202]:
- 1,8 ЭБк — 131
53I, - 0,085 ЭБк — 137
55Cs, - 0,01 ЭБк — 90
38Sr - 0,003 ЭБк — изотопы плутония,
- на долю благородных газов приходилось около половины от суммарной активности.
В настоящее время большинство жителей загрязнённой зоны получает менее 1 мЗв в год сверх естественного фона[202].
Источник энергии править
Этот раздел не завершён. |
Как известно, атомная энергия применяется для преобразования в электроэнергию за счёт нагревания воды, которая, испаряясь и образуя перегретый пар, вращает лопатки турбин электрогенераторов. Преимуществом данной технологии является отсутствие каких-либо парниковых газов, которые оказывают пагубное воздействие на окружающую среду. По состоянию за 2009 год 438 атомных станций по всему миру генерировали примерно 371,9 ГВт электроэнергии (или 13,8 % от общего объёма производства электроэнергии)[203]. Однако минусом ядерной промышленности являются ядерные отходы, которых в год отрабатывается приблизительно 12000 т[~ 19]. Данное количество отработанного материала представляет собой довольно сложную задачу перед сотрудниками АЭС[204]. К 1982 году было подсчитано, что аккумулировано ~300 т плутония[205].
Жёлто-коричневый порошок, состоящий из диоксида плутония, способен выдерживать нагревание до температуры 1200 °C. Синтез соединения происходит с помощью разложения тетрагидроксида или тетранитрата плутония в атмосфере кислорода[2]:
- .
Полученный порошок шоколадного цвета спекается и нагревается в токе влажного водорода до 1500 °C. При этом образуются таблетки плотностью 10,5—10,7 г/см³, которые можно использовать в качестве ядерного топлива[2]. Диоксид плутония является самым стабильным и инертным из оксидов плутония и посредством нагревания до высоких температур разлагается на составляющие, и потому применяется при переработке и хранении плутония, а также его дальнейшего использования как источника электроэнергии[206]. Один килограмм плутония эквивалентен примерно 22 млн кВт·ч тепловой энергии[205].
Плутоний-236 и плутоний-238 применяется для изготовления атомных электрических батареек, срок службы которых достигает 5 и более лет. Их применяют в генераторах тока, стимулирующих работу сердца (кардиостимулятор)[1][207]. По состоянию на 2003 г. в США было 50—100 человек, имеющих плутониевый кардиостимулятор[208]. Применение плутония-238 может распространиться на костюмы водолазов и космонавтов[209][210]. Бериллий вместе с вышеуказанным изотопом применяется как источник нейтронного излучения[37].
Космические аппараты править
В СССР было произведено несколько РИТЭГов Топаз, которые были предназначены для генерации электричества для космических аппаратов. Эти аппараты были предназначены работать с плутонием-238, который является α-излучателем. После развала Советского Союза США было закуплено несколько таких аппаратов для изучения их устройства и дальнейшего применения в своих долговременных космических программах[211].
Вполне достойной заменой плутонию-238 можно было бы назвать полоний-210. Его тепловыделение составляет 140 Вт/г, а всего один грамм может разогреться до 500 °C. Однако из-за его чрезвычайно малого для космических миссий периода полураспада (140 сут) применение этого изотопа в космической отрасли сильно ограничено[88] (например, он был использован в каждой миссии Луноходов, а также нашёл своё применение в искусственных спутниках Земли[212]).
Плутоний-238 в 2006 г. при запуске зонда New Horizons к Плутону нашёл своё применение в качестве источника питания для зонда[213]. Радиоизотопный генератор содержал 11 кг высокочистого диоксида 238Pu, производившего в среднем 220 Вт электроэнергии на протяжении всего пути (240 Вт в начале пути и 200 Вт к концу)[214][215]. Высказывались опасения о неудачном запуске зонда (шанс неудачи составлял 1:350), однако он всё-таки состоялся. 14 июля 2015 года был совершённ успешный пролёт Плутона. Сейчас аппарат исследует Пояс Койпера[216][217][218].
Зонды Галилео и Кассини были также оборудованы источниками энергии, в основе которых лежал плутоний[219]. Марсоход Curiosity получает энергию благодаря плутонию-238[220]. Его спуск на поверхность Марса состоялся 6 августа 2012 года. Марсоход использует Многоцелевой РИТЭГ (англ. Multi-Mission Radioisotope Thermoelectric Generator), производящий 125 Вт электрической мощности, а по истечении 14 лет — примерно 100 Вт[221]. Для работы марсохода производится 2,5 кВт·ч энергии за счёт распада ядер (солнечная энергия составит 0,6 кВт·ч)[222]. Плутоний-238 является оптимальным источником энергии, выделяющим 0,56 Вт·г−1. Применение этого изотопа с теллуридом свинца (PbTe), который используется в качестве термоэлектрического элемента, образует очень компактный и долговременный источник электричества без каких бы то ни было движущих частей конструкции[68], что позволяет не увеличивать габариты космических аппаратов.
Для будущих миссий НАСА был создан проект Усовершенствованного РИТЭГа Стирлинга (англ. Advanced Stirling radioisotope generator), который оказался бы в 4 раза эффективнее предыдущих поколений РИТЭГов. Обычный РИТЭГ преобразует 6 % тепловой энергии, выделяющейся в результате распада (8 кг 238Pu генерируют 4,4 кВт тепла, дающие аппарату 300 Вт электроэнергии), а улучшенный вариант позволил бы увеличить этот показатель до 25 % (те же 300 Вт электроэнергии вырабатывались бы из 2 кг изотопа). Космическое агентство дало начало этому проекту из-за недостатка, в частности, плутония-238 в мире[223][224].
На Луне править
Этот раздел не завершён. |
Несколько килограммов 238PuO2 использовались не только на Галилео, но и на некоторых миссиях Аполлонов[68]. Генератор электроэнергии SNAP-27 (англ. Systems for Nuclear Auxiliary Power), тепловая и электрическая мощность которого составляла 1480 Вт и 63,5 Вт соответственно, содержал 3,735 кг диоксида плутония-238[225]. Для уменьшения риска взрыва или иных возможных происшествий использовался бериллий в качестве термостойкого, лёгкого и прочного элемента[226]. SNAP-27 был последним типом генераторов, использовавшихся NASA для космических миссий; предыдущие типы (1, 7, 9, 11, 19, 21 и 23) использовали другие источники электроэнергии[227][228][229][230] (например, SNAP-19 Архивная копия от 4 января 2011 на Wayback Machine был использован в миссии Пионера-10[226][231]).
При проведении пассивного сейсмического эксперимента (PSEP) на Луне в миссии Аполлон-11 были использованы два радиоизотопных тепловых источника мощностью 15 Вт, которые содержали 37,6 г диоксида плутония в виде микросфер[13]. Генератор был использован в миссиях Аполлона-12 (отмечается, что это был первый случай использования ядерной энергосистемы при полёте на Луну), 14, 15, 16, 17[232]. Он был призван обеспечивать электроэнергией научное оборудование (англ. ALSEP), установленное на космических аппаратах[225]. Во время миссии Аполлона-13 произошло схождение лунного модуля с траектории, в результате чего он сгорел в плотных слоях атмосферы. Внутри SNAP-27 был использован вышеупомянутый изотоп, который окружён устойчивыми к коррозии материалами и будет храниться в них ещё 870 лет[233][234].
Первый китайский луноход Юйту, запуск которого произведён 1 декабря 2013 года, использует плутоний для подзарядки своих аккумуляторов в продолжительное ночное время[235].
Есть вероятность использования оружейного плутония в качестве дополнительного источника энергии на космической станции, которые планируется посадить на полюсе спутника Луна-27, так как солнечного света для её потребностей будет недостаточно[236][237]. Предположительно, старт аппарата Луна-27 должен быть произведён в 2027 г. одной из их задач будет являться исследование грунта на южном полюсе[238].
Реакторы-размножители править
Этот раздел не завершён. |
Для получения больших количеств плутония строятся реакторы-размножители («бридеры», от англ. to breed — размножать), которые позволяют нарабатывать значительные количества плутония[2]. Реакторы названы именно «размножителями» потому, что с их помощью возможно получение делящегося материала в количестве, превышающем его затраты на получение[68].
В США строительство первых реакторов данного типа началось ещё до 1950 г. В СССР и Великобритании к их созданию приступили в начале 1950 гг. Однако первые реакторы были созданы для изучения нейтронно-физических характеристик реакторов с жёстким спектром нейтронов. Поэтому первые образцы должны были продемонстрировать не большие производственные количества, а возможность реализации технических решений, закладываемых в первые реакторы такого типа («Клементина», EBR-1, БР-1, БР-2)[239].
Отличие реакторов-размножителей от обычных ядерных реакторов состоит в том, что нейтроны в них не замедляются, то есть отсутствует замедлитель нейтронов (например, графит). Быстрые нейтроны с некоторой вероятностью делят не только 235U, но и 238U, а также выбивают большее количество вторичных нейтронов[источник не указан 586 дней]. Это позволяет избытку нейтронов прореагировать с 238U собразованием урана-239, который в дальнейшем и образует плутоний-239[211]. В таких реакторах центральная часть, содержащая диоксид плутония в обеднённом диоксиде урана, окружена оболочкой из ещё более обеднённого диоксида урана-238 (238UO2), в которой и образуется 239Pu. Используя вместе 238U и 235U, такие реакторы могут производить из природного урана энергии в 50—60 раз больше, позволяя таким образом использовать запасы наиболее пригодных для переработки урановых руд[68]. Коэффициент воспроизводства рассчитывается отношением произведённого ядерного топлива к затраченному. Однако достижение высоких показателей воспроизводства — нелёгкая задача. ТВЭЛы в них должны охлаждаться чем-то отличным от воды, которая замедляет нейтроны (на быстрых нейтронах больше коэффициент воспроизводства). Было предложено использование жидкого натрия в качестве охлаждающего элемента. В реакторах-размножителях используют обогащённый более 15 % по массе уран-235, для достижения необходимого нейтронного облучения и коэффициента воспроизводства примерно 1—1,2[211].
В настоящее время экономически более выгодно получение урана из урановой руды, обогащённой до 3 % ураном-235, чем размножение урана в плутоний-239 с применением урана-235, обогащённого на 15 %[211]. Проще говоря, преимуществом бридеров является способность в процессе работы не только производить электроэнергию, но и утилизировать непригодный в качестве ядерного горючего уран-238[240].
Противопожарные датчики править
Плутоний-239 широко использовался в серийно выпускаемых ионизационных извещателях РИД-1, работа которых основана на эффекте ослабления ионизации воздушного межэлектродного промежутка дымом[241][242]. Данные дымоизвещатели достаточно массово устанавливались в самых различных учреждениях и организациях, включаясь в систему противопожарной безопасности помещения. Дымоизвещатель состоит из двух ионизационных камер, рабочей и контрольной. В каждой камере находится источник ионизирующего излучения АДИ, содержащий реакторный плутоний (главным образом Pu-239). Принцип работы состоит в следующем: в ионизационной камере за счёт альфа-излучения плутония сопротивление ионизированного воздуха уменьшается, воздух из изолятора превращается в проводник. При подаче напряжения через ионизационные камеры протекает некоторый ток. При установке дымоизвещателя путём регулировки одного из источников АДИ (в рабочей камере, открытой для внешнего воздуха) добиваются протекания такого же тока, как и во второй, контрольной (закрытой) камере. Если в процессе эксплуатации в помещении возникает пожар и в рабочую камеру попадает дым, ток в рабочей камере меняется по сравнению с контрольной, это определяется электроникой и срабатывает тревога[243].
Стоимость плутония править
Один грамм плутония-238 (используется в РИТЭГ) до 1971 года стоил около тысячи долларов США[209], в 2010-х стоимость оценивалась в 4 тысячи[244].
В 1992 г. США договорились купить у России 30 кг плутония-238 за 6 млн долларов США (200 тыс./кг); в итоге было доставлено около 20 кг[223].
См. также править
Примечания править
Комментарии
- ↑ Отношение . См. раздел нахождение в природе.
- ↑ Для того, чтобы считать новый химический элемент открытым, следовало доказать, что он обладает новыми свойствами: как физическими, так и химическими. Предположения о свойствах плутония высказывались ещё в мае 1940 года Льюисом Тернером
- ↑ С 24 августа 2006 года по решению Международного астрономического союза Плутон более не является планетой Солнечной системы
- ↑ По сообщению источника, во время интервью Сиборг сказал: «Очевидным выбором для меня были две буквы Pl, однако я в шутку предложил обозначить элемент Pu, как иногда дети кричат „Pee-yoo!“, когда кто-то плохо пахнет.» Сиборг считал, что именно Pl будет принято в качестве обозначения плутония, однако комитет выбрал Pu
- David L. Clark. Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912—1999. — Журнал Los Alamos Science, 2000. — Вып. 26. — С. 56—61, 57. Архивировано 4 июня 2011 года.
- ↑ Применение взрывчатых линз, которые имели форму футбольного мяча, внутри которого, условно, находился плутониевый заряд, позволяло достичь увеличения мощности взрыва. Чем равномернее со всех сторон сжимался ядерный заряд, тем мощнее был ядерный взрыв.
- ↑ По сообщению источника латунная ампула, на которой располагается бериллий и полоний, диаметром в 2 и высотой 4 см позволяет достичь выхода 90 млн нейтронов в секунду.
- ↑ Соединение гадолиния и циркония с кислородом (Gd2Zr2O7) было создано в связи с тем, что оно позволяет удерживать плутоний на протяжении 30 млн лет.
- ↑ Плутоний находится в пакете для того, чтобы предотвратить альфа-излучение и, возможно, для термоизоляции.
- ↑ Температура кипения плутония в пять раз больше температуры плавления. Для сравнения: у вольфрама этот показатель составляет 1,6 (темп. плавления 3422 °C и кипения 5555 °C).
- ↑ Данный эффект связан с тем, что кислород, реагируя с плутонием и образуя смешанные оксиды на поверхности плутония, препятствует коррозии плутония, по крайней мере, снаружи. Аргон не реагирует с плутонием и одновременно препятствует химическим реакциям плутония, в итоге его поверхность ничем не пассивирована и подвергается коррозии вследствие саморазогрева.
- ↑ Амплитуда колебаний показателей плотности плутония составляет 4 г/см³ (точнее: 3,94 г/см³).
- ↑ PuO2+ ион нестабильный в водном растворе и может диспропорционировать в Pu4+ и PuO22+; Pu4+ затем может окислиться с PuO2+ до PuO22+, будучи ионом Pu3+. Таким образом, с течением времени водные растворы Pu3+ могут соединяться с кислородом образуя оксид PuO22+
- Crooks, William J. Nuclear Criticality Safety Engineering Training Module 10 — Criticality Safety in Material Processing Operations, Part 1 (2002). Дата обращения: 5 сентября 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ Например, нейтронов из космического излучения, нейтронов от спонтанного деления урана-238 и от (α,n)-реакций на лёгких ядрах.
- ↑ Предполагается, что у церия валентность равна 3,6
- ↑ δ-фаза стабилизируется при комнатной температуре растворением 2 ат.% Ga
- ↑ δ-фаза остаётся при комнатной температуре в метастабильном состоянии, если растворить 1 ат.% Ga и быстро охладить
- ↑ Следует учитывать, что выработка наиболее оптимальной конструкции ядерной бомбы вырабатывалась годами.
- ↑ Образец.
- ↑ Однако эта цифра сильно разнится. Из этого количества плутоний можно получить в сотни раз меньших количествах.
- ↑ Остальные изотопы имеют чрезвычайно малые показатели тепловыделения по сравнению с 238Pu, и потому не применяются в качестве источника энергии. См. таблицу в разделе свойства некоторых изотопов.
Источники
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Дриц М. Е. и др. Свойства элементов. — Справочник. — М.: Металлургия, 1985. — 672 с. — 6500 экз.
- ↑ 1 2 3 4 5 Неорганическая химия в трёх томах / Под ред. Ю. Д. Третьякова. — М.: Издательский центр «Академия», 2007. — Т. 3. — 400 с. — (Химия переходных элементов). — 3000 экз. — ISBN 5-7695-2533-9.
- ↑ Plutonium (англ.). AmericanElements.com. Дата обращения: 11 января 2011. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 4 5 Плутоний — статья из Физической энциклопедии
- ↑ 1 2 3 Радиоактивные вещества / Под общ. ред. акад. АМН СССР Ильина Л. А. и др. — Справ. изд. — Л.: "Химия", 1990. — 464 с. — (Вредные химические вещества). — 35 150 экз. — ISBN 5-7245-0216-X.
- ↑ 1 2 Plutonium: the essentials (англ.). WebElements. Дата обращения: 29 декабря 2010. Архивировано 7 января 2011 года.
- ↑ 1 2 3 4 Мед—Пол // Химическая энциклопедия / Глав. ред. И. Л. Кнунянц. — М.: Большая Российская Энциклопедия, 1992. — Т. 3. — С. 580. — 639 с. — (Химическая энциклопедия в 5ти томах). — 50 000 экз. — ISBN 5-85270-039-8.
- ↑ David R. Lide. Vapor Pressure // CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data. — 90-е изд. — Taylor and Francis, 2009. — С. 6—77. — 2828 с. — ISBN 1420090844, 9781420090840.
- ↑ Plutonium: crystal structure (англ.). Дата обращения: 25 августа 2010. Архивировано 7 июня 2010 года.
- ↑ 1 2 3 4 5 6 7 8 Милюкова М. С., Гусев Н. И., Сентюрин И. Г., Скляренко И. С. Аналитическая химия плутония. — М.: "Наука", 1965. — 447 с. — (Аналитическая химия элементов). — 3400 экз.
- ↑ 1 2 3 Plutonium (англ.). Human Health Fact Sheet. Argonne National Laboratory (август 2005). Дата обращения: 21 ноября 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ 1 2 3 Richard D. Baker. Plutonium: A Wartime Nightmare but a Metallurgist's Dream // Соавт.: Hecker, Siegfried S.; Harbur, Delbert R. Los Alamos Science. — Los Alamos National Laboratory, 1983. — С. 148, 150—151. Архивировано 17 октября 2011 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Ф. Вайгель, Дж. Кац, Г. Сиборг и др. Химия актиноидов = The Chemistry of the Actinide Elements / Пер. с англ. под ред. Дж. Каца, Г. Сиборга, Л. Морсса. — Москва: «Мир», 1997. — Т. 2. — 664 с. — (Химия актиноидов). — 500 экз. — ISBN 5-03-001885-9.
- ↑ 1 2 Плутоний. allmetals.ru. Дата обращения: 26 ноября 2010. Архивировано 13 августа 2014 года.
- ↑ 1 2 3 4 5 6 Плутоний // Серебро—Нильсборий и далее / Ред.: Петрянов-Соколов И. В. — 3-е изд. — М.: "Наука", 1983. — Т. 2. — 570 с. — (Популярная библиотека химических элементов). — 50 000 экз.
- ↑ Transuranium element — статья из Британской энциклопедии
- ↑ Edwin McMillan, Philip Hauge Abelson. Radioactive Element 93 (англ.) // Phys. Rev : статья. — American Physical Society, 1940. — Iss. 57, no. 12. — P. 1185—1186. — doi:10.1103/PhysRev.57.1185.2.
- ↑ Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — 3-е изд. — Butterworth-Heinemann, 2002. — 709 с. — ISBN 0750674636, 9780750674638.
- ↑ Glenn T. Seaborg. The Transuranium Elements (англ.) // Журнал Science : статья. — 25 октября 1946. — Iss. 104, no. 2704. — P. 379—386. — doi:10.1126/science.104.2704.379. — PMID 17842184.
- ↑ 1 2 Пирометаллургия—С // Краткая химическая энциклопедия / Глав. ред.: И. Л. Кнунянц и др. — М.: "Советская энциклопедия", 1965. — Т. 4. — С. 90—92. — 1182 с. — (Энциклопедии. Словари. Справочники). — 81 000 экз.
- ↑ Тучков, В. Советская бомба с американским акцентом : [арх. 5 апреля 2010] // Вокруг Света : журн. — 2009. — 27 августа.
- ↑ 1 2 Аркадий Круглов. Американцы заплатили за уничтожение плутония // Газета Коммерсантъ : статья. — Томск: Коммерсантъ, 2003. — Вып. 2753, № 150.
- ↑ Uncovering the Secrets of Actinides (англ.) (pdf). Actinides Can Mean Nuclear Chemistry 17. Lawrence Livermore National Laboratory (июнь 2000). Дата обращения: 22 марта 2011. Архивировано из оригинала 13 августа 2012 года.
- ↑ РФЯЦ-ВНИИЭФ, 1996, с. 11.
- ↑ Holden, Norman E. A Short History of Nuclear Data and Its Evaluation (англ.). 51st Meeting of the USDOE Cross Section Evaluation Working Group. Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory (2001). Дата обращения: 11 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ Fermi, Enrico Artificial radioactivity produced by neutron bombardment: Nobel Lecture (англ.). Royal Swedish Academy of Sciences (12 декабря 1938). Дата обращения: 11 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ Darden, Lindley. Enrico Fermi: "Transuranium" Elements, Slow Neutrons // The Nature of Scientific Inquiry. — College Park (MD): Department of Philosophy, University of Maryland, 1998. Архивировано 17 августа 2012 года.
- ↑ Кудрявцев П. С. Курс истории физики. — М.: Просвещение, 1982. — С. 70. — 448 с. Архивировано 17 февраля 2012 года.
- ↑ Glenn T. Seaborg. The plutonium story. Lawrence Berkeley Laboratory, University of California (сентябрь 1981). Дата обращения: 16 марта 2022. Архивировано 16 мая 2013 года.
- ↑ Michael McClure. The New Alchemy. The Search Went On... (англ.) // Журнал ChemMatters : статья. — American Chemical Society (ACS), октябрь 2006. — P. 17. Архивировано 17 октября 2011 года.
- ↑ Алексей Левин. Хассий-долгожитель. Элементы.Ру (19 декабря 2006). Дата обращения: 27 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ The Nobel Prize in Chemistry 1951 (англ.). NobelPrize.org (2 января 2011). Дата обращения: 2 января 2011. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 Boris E. Burakov, Michael I. Ojovan, William (Bill) E. Lee. Introdution to the Actinides // Crystalline Materials for Actinide Immobilisation. — World Scientific Publishing Company, Inc, 2010. — Т. 1. — 197 с. — ISBN 1848164181, 9781848164185. Архивировано 28 декабря 2010 года. Архивированная копия. Дата обращения: 30 декабря 2010. Архивировано 28 декабря 2010 года.
- ↑ Edwin M. McMillan. The transuranium elements: early history (англ.) (pdf). Nobel Lecture (12 декабря 1951). Дата обращения: 24 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Бекман И. Н. Плутоний. — Учебное пособие. — М.: МГУ им. М. В. Ломоносова, 2009. Архивировано 8 марта 2022 года.
- ↑ 1 2 3 National Research Council (U.S.). Subcommittee on Nuclear and Radiochemistry. A Review of the accomplishments and promise of U.S. transplutonium research, 1940–1981. — National Academies, 1982. — 83 с.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 John, Emsley. Plutonium // Nature's Building Blocks: An A—Z Guide to the Elements (англ.). — Oxford: Oxford University Press, 2003. — 538 p. — ISBN 0198503407, 9780198503408.
- ↑ Wahl, professor who discovered plutonium; 89 (англ.). Newsroom. Washington University in St. Louis (27 апреля 2006). Дата обращения: 13 января 2011. Архивировано 22 августа 2011 года.
- ↑ Joseph W. Kennedy (англ.). Staff Biographies. Los Alamos National Laboratory. Дата обращения: 13 января 2011. Архивировано 22 августа 2011 года.
- ↑ Glenn T. Seaborg. The Plutonium Story (англ.). Lawrence Berkeley Laboratory, University of California. Дата обращения: 2 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Gerhart Friedlander, Alfred M. Holtzer, Demetrios G. Sarantites, Lee G. Sobotka, Samual I. Weissman. Arthur C. Wahl (англ.). Death notice. Physics Today (11 июля 2006). Дата обращения: 13 января 2011. Архивировано 15 октября 2008 года.
- ↑ Seaborg, G. T. The Transuranium Elements (англ.) // Katz, J. J., and Manning, W. M. (eds) Natl Nucl. En. Ser., Div IV, 14B : статья. — New-York: McGraw-Hill, 1949. — P. 1.2, 5.
- ↑ Scott F. A., Peekema R. M. Progress in Nuclear Energy. — 1-е изд. — London: Pergamon Press, 1959. — С. 65.
- ↑ 1 2 Albert Stwertka. Plutonium // Guide to the Elements (англ.). — Oxford: Oxford University Press, 1998. — ISBN 0-19-508083-1.
- ↑ 1 2 3 4 Glenn T. Seaborg. Modern alchemy: selected papers of Glenn T. Seaborg. — World Scientific, 1994. — 696 с.
- ↑ Гребеников Е. А., Рябов Ю. А. Открытие Плутона // Поиски и открытия планет. — 2-е изд., перераб. и доп. — М.: "Наука", 1984. — С. 156—162. — 224 с. — 100 000 экз.
- ↑ Rincon, Paul The girl who named a planet (англ.). BBC News (13 января 2006). Дата обращения: 7 ноября 2010. Архивировано 22 августа 2011 года.
- ↑ Plutonium (англ.). History & Etymology. Elementymology & Elements Multidict. Дата обращения: 14 января 2011. Архивировано 22 августа 2011 года.
- ↑ 1 2 PBS contributors. Frontline interview with Seaborg (англ.). Frontline. Public Broadcasting Service (1997). Дата обращения: 11 сентября 2010. Архивировано 5 января 2009 года.
- ↑ 1 2 Химический факультет МГУ. Плутоний, Plutonium, Pu (94). Открытие элементов и происхождение их названий. МГУ. Дата обращения: 9 ноября 2010. Архивировано 8 октября 2010 года.
- ↑ 1 2 3 4 5 6 7 Heiserman, David L. Element 94: Plutonium // Exploring Chemical Elements and their Compounds. — New York: TAB Books, 1992. — С. 337—340. — ISBN 0-8306-3018-X.
- ↑ David L. Clark. Reflections on the Legacy of a Legend: Glenn T. Seaborg, 1912—1999. — Журнал Los Alamos Science, 2000. — Вып. 26. — С. 56—61, 57. Архивировано 4 июня 2011 года.
- ↑ NPS contributors. Room 405, George Herbert Jones Laboratory (англ.). National Park Service. Дата обращения: 11 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ Cunningham, B. B. and Werner, L. B. The Transuranium Elements (англ.) // Ред. кол.: G. T. Seaborg, J. J. Katz, W. M. Manning Natl Nucl. En. Ser., Div IV, 14B : статья. — New-York: McGraw-Hill, 1949. — P. 1.8, 51.
- ↑ Seaborg, G. T. History of Met Lab Section C1 (англ.) // Report P-112 : статья. — 1942—1943. — Iss. 1.
- ↑ Glenn T. Seaborg и др. The First Weighing of Plutonium (англ.) (pdf) vi. United States Atomic Energy Comission. University of Chicago (10 сентября 1967). Дата обращения: 13 января 2011. Архивировано 22 августа 2011 года.
- ↑ Thompson's Process (англ.). The University of California (16 октября 2006). Дата обращения: 16 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 William N. Miner. The Encyclopedia of the Chemical Elements / Под ред. Clifford A. Hampel; соавт. Schonfeld, Fred W. — New York: Reinhold Book Corporation, 1968.
- ↑ 1 2 3 4 5 6 Плутоний // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ История создания первой в СССР радиохимической технологии получения плутония (pdf). Радиевый институт им. В. Г Хлопина. Дата обращения: 2 января 2011. Архивировано из оригинала 22 августа 2011 года.
- ↑ Ковалёва, С. Плутоний в девичьих руках: создательницы «ядерного щита» Родины работали без страховки и отпусков // Независимая газета : статья. — 14 октября 1997. — С. 6. Архивировано 19 сентября 2011 года.
- ↑ 1 2 Ефимова, Мария MI5 обнаружила советского шпиона среди Нобелевских лауреатов. gzt.ru (26 августа 2010). Дата обращения: 22 октября 2010. Архивировано 4 ноября 2012 года.
- ↑ Pa, this requires action! (англ.) (pdf). The Atomic Heritage Foundation. Дата обращения: 24 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Vincent C. Jones. Manhattan, the Army and the Atomic Bomb / В соавт. с Center of Military History (U.S. Army). — Вашингтон: Government Printing Office, 1985. — 680 с. — ISBN 0160019397, 9780160019395.
- ↑ LANL contributors. Site Selection (англ.). LANL History. Los Alamos, New Mexico: Los Alamos National Laboratory. Дата обращения: 11 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ Site of the First Self-Sustaining Nuclear Reaction (англ.). National Historic Landmark summary listing. National Park Service. Дата обращения: 24 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Hans A. Bethe. The German Uranium Project (англ.) // Physics Today : статья. — Physics Today Online, июль 2000. — Iss. 53, no. 7. — doi:10.1063/1.1292473. (недоступная ссылка)
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 Гринвуд Н. Н., Эрншо А. Химия элементов = Chemistry of the elements / Пер. с англ. ред. кол. — Учебное пособие. — М.: Бином. Лаборатория знаний, 2008. — Т. 2. — 607 с. — (Лучший зарубежный учебник. В 2-х томах). — 2000 экз. — ISBN 978-5-94774-373-9.
- ↑ CP-1 Goes Critical (англ.). The Manhattan Project. An Interactive History. US DOE. Office of History and Heritage Resources. Дата обращения: 24 декабря 2010. Архивировано из оригинала 29 сентября 2006 года.
- ↑ Final Reactor Design and X-10 (англ.). The Manhattan Project. An Interactive History. US DOE. Office of History and Heritage Resources. Дата обращения: 1 января 2011. Архивировано из оригинала 29 сентября 2006 года.
- ↑ ORNL Metals and Ceramics Division, History 1946—1996 (англ.) (pdf). Oak Ridge National Laboratory (8 марта 1999). — 154 стр. Дата обращения: 23 декабря 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ 1 2 X-10 (англ.). The Tennessee Encyclopedia of History and Science (2002). Дата обращения: 23 декабря 2010. Архивировано из оригинала 30 сентября 2007 года.
- ↑ Oak Ridge National Laboratory (англ.). The Tennessee Encyclopedia of History and Science (2002). Дата обращения: 24 декабря 2010. Архивировано 30 сентября 2007 года.
- ↑ Carey Sublette. Atomic History Timeline 1942—1944 (англ.). Washington (DC): Atomic Heritage Foundation. Дата обращения: 11 сентября 2010. Архивировано 4 января 2009 года.
- ↑ 1 2 F. G. Gosling. Elimination of Thin Man // The Manhattan Project: making the atomic bomb. — DIANE Publishing, 1999. — С. 40. — 66 с. — ISBN 0788178806, 9780788178801.
- ↑ B Reactor (англ.). U.S. Department of Energy. Дата обращения: 1 января 2011. Архивировано из оригинала 16 сентября 2008 года.
- ↑ Michele S. Gerber, Brian Casserly, Frederick L. Brown. B Reactor (англ.) (pdf) 4. National Historic Landmark Nomination (февраль 2007). Дата обращения: 1 января 2011. Архивировано 22 августа 2011 года.
- ↑ Американцы проложили туристический маршрут через старый ядерный реактор. Lenta.ru (24 сентября 2007). Дата обращения: 18 ноября 2010. Архивировано 22 августа 2011 года.
- ↑ 1 2 Hanford Site Cleanup Completion Framework (англ.) (pdf). Department of Enegry. Hanford (июль 2010). — Более подробное описание районов можно найти в главе 2.3.1. Дата обращения: 7 ноября 2010. Архивировано 22 августа 2011 года.
- ↑ Long-Range Deep Vadose Zone Program Plan (англ.) (pdf). Department of Enegry. Hanford (октябрь 2010). Дата обращения: 7 ноября 2010. Архивировано 22 августа 2011 года.
- ↑ Historic Sample Of Bomb-Grade Plutonium Discovered (англ.). ScienceDaily Online (5 марта 2009). Дата обращения: 25 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Rincon, Paul (2009-03-02). "BBC NEWS — Science & Environment — US nuclear relic found in bottle". BBC News. Архивировано из оригинала 2 марта 2009. Дата обращения: 11 сентября 2010.
- ↑ Erika Gebel. Old plutonium, new tricks. — Журнал Analytical Chemistry, 2009. — Вып. 81, № 5. — С. 1724. — doi:10.1021/ac900093b.
- ↑ Jon M. Schwantes. Nuclear archeology in a bottle: Evidence of pre-Trinity U.S. weapons activities from a waste burial site. — Журнал Analytical Chemistry, 2009. — Вып. 81, № 4. — С. 1297—1306. — doi:10.1021/ac802286a. — PMID 19152306.
- ↑ Вести ФМ (2010-07-16). "Работа по созданию атомной бомбы была сделана удивительно быстро и качественно. История с Андреем Светенко". Вести.Ру. Архивировано из оригинала 3 марта 2012. Дата обращения: 29 октября 2010.
- ↑ A. J. Fahey, C. J. Zeissler, D. E. Newbury, J. Davis, and R. M. Lindstrom. Postdetonation nuclear debris for attribution (англ.). — Proceedings of the National Academy of Sciences of the United States of America, 2010. — doi:10.1073/pnas.1010631107.
- ↑ Испытание первого в мире атомного устройства. Справка. РИА Новости (16 июля 2010). — Материал подготовлен на основе информации открытых источников. Дата обращения: 4 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ 1 2 Polonium (англ.) (pdf). Human Health Fact Sheet. Aragonne National Laboratory (август 2005). Дата обращения: 22 декабря 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ Sublette, Carey 8.1.1 The Design of Gadget, Fat Man, and «Joe 1» (RDS-1) (англ.). Nuclear Weapons Frequently Asked Questions, edition 2.18. The Nuclear Weapon Archive (3 июля 2007). Дата обращения: 17 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ Лесли Гровс. Выбор цели // [www.lib.ru/MEMUARY/MANHATTEN/grove.txt Теперь об этом можно рассказать. История Манхэттенского проекта] = Now it can be told. The story of Manhattan project. — М.: Атомиздат, 1964.
- ↑ John Malik. The Yields of the Hiroshima and Nagasaki Explosions. — Los Alamos: Los Alamos, 1985. Архивировано 14 марта 2021 года. — Таблица VI.
- ↑ Валерий Чумаков. Мирный фатум // Журнал «Вокруг Света» : статья. — «Вокруг Света», 2009. — Вып. 2831, № 12. Архивировано 9 июня 2010 года.
- ↑ DOE contributors. Historic American Engineering Record: B Reactor (105-B Building). — Richland (WA): U.S. Department of Energy. — С. 110. Архивировано 7 марта 2021 года.
- ↑ Cochran, Thomas B. Safeguarding nuclear weapons-usable materials in Russia (PDF). International Forum on Illegal Nuclear Traffic. Washington (DC): Natural Resources Defense Council, Inc. Архивировано (PDF) из оригинала 5 июля 2013. Дата обращения: 17 сентября 2010.
{{cite conference}}: Неизвестный параметр|deadlink=игнорируется (|url-status=предлагается) (справка) - ↑ 1 2 3 4 CRC contributors. Handbook of Chemistry and Physics / Ред.: David R. Lide. — 87-е изд. — Boca Raton: CRC Press, Taylor & Francis Group, 2006. — ISBN 0849304873.
- ↑ Stockholm International Peace Research Institute. SIPRI Yearbook 2007: Armaments, Disarmament, and International Security (англ.). — Oxford University Press, 2007. — P. 567. — ISBN 0199230218, 9780199230211.
- ↑ Department of Energy Files Motion to Withdraw Yucca Mountain License Application (англ.). Department of Energy (DOE) (3 марта 2010). Дата обращения: 20 декабря 2010. Архивировано из оригинала 14 мая 2011 года.
- ↑ 1 2 3 Moss, William. The Human Plutonium Injection Experiments (англ.) // Eckhardt, Roger Журнал Los Alamos Science. — Los Alamos National Laboratory, 1995. — Iss. 23. — P. 188, 205, 208, 214. Архивировано 20 февраля 2021 года.
- ↑ 1 2 George L., Voelz. Plutonium and Health: How great is the risk? (англ.) // Журнал Los Alamos Science. — Los Alamos (NM): Los Alamos National Laboratory, 2000. — No. 26. — P. 78—79.
- ↑ Плутоний = Plutonium Handbook. A Guide to the Technology / Перев. с англ. Под ред. В. Б. Шевченко и В. К. Маркова. — Справочник. — М.: Атомиздат, 1971. — Т. 1. — С. 12. — 428 с. — 2260 экз.
- ↑ 1 2 3 4 5 NIH contributors. Plutonium, Radioactive (англ.). Bethesda (MD): U.S. National Library of Medicine, National Institutes of Health. — Wireless Information System for Emergency Responders (WISER). Дата обращения: 4 сентября 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ ARQ staff. Nitric acid processing (англ.) // Actinide Research Quarterly. — Los Alamos (NM): Los Alamos National Laboratory, 2008. Архивировано 27 мая 2010 года. Проверено 4 сентября 2010.
- ↑ 1 2 3 4 5 Пер. с англ. языка под ред. Б. А. Надыкто и Л. Ф. Тимофеевой. Плутоний. — Саров: РФЯЦ-ВНИИЭФ, 2003. — Т. 2. — 203 с. — (Фундаментальные проблемы). — 500 экз. — ISBN 5-9515-00-24-9.
- ↑ Taking Stock: A Look At The Opportunities And Challenges Posed By Inventories From The Cold War Era. — 1-е изд. — DIANE Publishing Company, 2004. — 190 с. — ISBN 0788138081, 9780788138089.
- ↑ 1 2 3 Kolman, D. G. and Colletti, L. P. ECS transactions (англ.) // 16-е изд. — Electrochemical Society, 2009. — Iss. 52. — P. 71. — ISSN 1938-5862.
- ↑ 1 2 3 NNDC contributors; Alejandro A. Sonzogni (Database Manager).: Chart of Nuclides (англ.). Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory (2008). Дата обращения: 4 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ Richard Rhodes. The Making of the Atomic Bomb. — New York: Simon & Schuster, 1986. — С. 659—660. — ISBN 0-671-65719-4.
- ↑ 1 2 3 4 5 6 7 Siegfried S. Hecker. Plutonium and its alloys: from atoms to microstructure // 26-е изд. — Los Alamos Science, 2000. — С. 290—335. Архивировано 19 марта 2021 года.
- ↑ Wick, O. J. (ed.). Plutonium handbook, A Guide to the Technology / Am. Nucl. Soc. — Reprint. — New York: Gordon & Breach, 1980.
- ↑ Oetting, F. L., Rand, M. H., Ackerman, R. J. The Chemical Thermodynamics of Actinide Elements and their Compounds. — Ч. 1. — Vienna: IAEA, 1976. — С. 24.
- ↑ Oswald J. Wick. Плутоний = Plutonium Handbook: A Guide to the Technology / Под ред. О. Вика. — Справ. изд. — М.: Атомиздат, 1973. — Т. 2. — 456 с. — 2100 экз.
- ↑ 1 2 3 4 Александр Прищепенко. Дамоклов меч: Атомная бомба // Популярная механика : статья. — январь 2009. Архивировано 21 мая 2012 года.
- ↑ "Plutonium Crystal Phase Transitions" (англ.). GlobalSecurity.org. Архивировано из оригинала 1 октября 2009. Дата обращения: 5 сентября 2010.
- ↑ Актиноиды — статья из Физической энциклопедии
- ↑ Нептуний. Нептуний и плутоний – семивалентные. Популярная библиотека химических элементов (27 сентября 2003). Дата обращения: 11 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ George, Matlack. A Plutonium Primer: An Introduction to Plutonium Chemistry and its Radioactivity. — Los Alamos National Laboratory, 2002.
- ↑ 1 2 3 4 5 Rita Cornelis, Joe Caruso, Helen Crews, Klaus Heumann. Handbook of elemental speciation II: species in the environment, food, medicine & occupational health. — Перепечатанное и иллюстрированное. — John Wiley and Sons, 2005. — 768 с. — ISBN 0470855983, 9780470855980.
- ↑ 1 2 3 Dumé, Belle (2002-11-20). "Plutonium is also a superconductor" (англ.). PhysicsWeb.org. Архивировано из оригинала 12 января 2012. Дата обращения: 5 сентября 2010.
- ↑ Mary, Eagleson. Concise Encyclopedia Chemistry. — Walter de Gruyter, 1994. — С. 840. — ISBN 9783110114515.
- ↑ Cleveland, J. M. Ind. Eng. Chem. Process Des. Dev (англ.). — 1965. — No. 4. — P. 230.
- ↑ Cleveland, J. M. J. Inorg. Nucl. Chem (англ.). — 1964. — No. 26. — P. 461—467.
- ↑ Jenkis, W. J. J. Inorg. Nucl. Chem (англ.). — 1963. — No. 25. — P. 463—464.
- ↑ [bse.sci-lib.com/article089986.html Плутоний]. БСЭ. Дата обращения: 21 октября 2010. Архивировано 4 ноября 2012 года.
- ↑ Crooks, W. J. и др. Low Temperature Reaction of ReillexTM HPQ and Nitric Acid. — 20-е изд. — Solvent Extraction and Ion Exchange, 2002. — С. 543. Архивировано 14 июня 2011 года.
- ↑ DOE contributors. Oklo: Natural Nuclear Reactors. U.S. Department of Energy, Office of Civilian Radioactive Waste Management (2004). Дата обращения: 7 сентября 2010. Архивировано из оригинала 2 июня 2010 года.
- ↑ David Curtis. Nature's uncommon elements: plutonium and technetium / Fabryka-Martin, June; Paul, Dixon; Cramer, Jan. — 63. — Журнал «Geochimica et Cosmochimica Acta», 1999. — С. 275—285.
- ↑ Hoffman, D. C.; Lawrence, F. O.; Mewherter, J. L.; Rourke, F. M. Detection of Plutonium-244 in Nature (англ.) // Nature : статья. — 1971. — Iss. 234. — P. 132—134. — doi:10.1038/234132a0. Архивировано 3 марта 2016 года.
- ↑ Lachner, J.; et al. (2012). "Attempt to detect primordial 244Pu on Earth". Physical Review C. 85 (1): 015801. Bibcode:2012PhRvC..85a5801L. doi:10.1103/PhysRevC.85.015801.
- ↑ Wallner, A.; Faestermann, T.; Feige, J.; Feldstein, C.; Knie, K.; Korschinek, G.; Kutschera, W.; Ofan, A.; Paul, M.; Quinto, F.; Rugel, G.; Steier, P. (2015). "Abundance of live 244Pu in deep-sea reservoirs on Earth points to rarity of actinide nucleosynthesis". Nature Communications. 6: 5956. arXiv:1509.08054. Bibcode:2015NatCo...6.5956W. doi:10.1038/ncomms6956. ISSN 2041-1723. PMC 4309418. PMID 25601158.
- ↑ Peterson, Ivars. Uranium displays rare type of radioactivity (англ.). Science News (7 декабря 1991). Дата обращения: 7 сентября 2010. Архивировано 18 января 2012 года.
- ↑ Anthony L. Turkevich, Thanasis E. Economou, and George A. Cowan. Double-beta decay of 238U (англ.) // Phys. Rev. Lett. : journal. — 1991. — Vol. 67. — P. 3211. — doi:10.1103/PhysRevLett.67.3211.
- ↑ Волков В. А. и др. Выдающиеся химики мира / Под ред. проф. Кузнецова В. И. — Биографический справочник. — М.: Высшая школа, 1991. — С. 407. — 656 с. — 100 000 экз. — ISBN 5-06-001568-8.
- ↑ EPA contributors. Fissile Material. Radiation Glossary. United States Environmental Protection Agency (2008). Дата обращения: 5 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ G. Audi, O. Bersillon, J. Blachnot, A. H. Wapstra. The Nubase evaluation of nuclear and decay properties (англ.) (pdf). Nuclear Physics (2003). — Таблица с описанием ядерных свойств изотопов и периодами их полураспада. Дата обращения: 9 ноября 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ 94-plutonium (англ.). Korea Atomic Energy Research Institute (2002). Дата обращения: 28 декабря 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra. The Nubase evaluation of nuclear and decay properties (англ.) // Журнал Nuclear Physics : статья. — 2003. — Iss. 128. — P. 3—128. Архивировано 20 июля 2011 года.
- ↑ 1 2 Таблица нуклидов МАГАТЭ (англ.). International Atomic Energy Agency. Дата обращения: 28 октября 2010. Архивировано из оригинала 6 февраля 2011 года.
- ↑ 1 2 3 4 5 David Albright, Frans Berkhout, William Walker, Stockholm International Peace Research Institute. World inventory of plutonium and highly enriched uranium (англ.). — Oxford University Press, 1993. — 246 p. — ISBN 0198291531, 9780198291534.
- ↑ 1 2 У плутония-237 основным каналом распада является электронный захват, однако обнаружен также менее вероятный канал альфа-распада. У плутония-241 основным каналом распада является бета-минус-распад, однако обнаружены также менее вероятные каналы альфа-распада и спонтанного деления.
- ↑ Тимошенко, Алексей (2010-10-12). "Обама открыл «частникам» дорогу в космос". gzt.ru. Архивировано из оригинала 15 октября 2010. Дата обращения: 22 октября 2010.
{{cite news}}: Неизвестный параметр|deadlink=игнорируется (|url-status=предлагается) (справка) - ↑ J. W. Kennedy. Properties of Element 94 / Соавт.: Seaborg, G. T.; Segrè, E.; Wahl, A. C. — 70-е изд. — Physical Review, 1946. — С. 555—556.
- ↑ N. N. Greenwood. Chemistry of the Elements / Соавт.: Earnshaw, A. — 2-е изд. — Oxford: Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4.
- ↑ Roger Case и др. Environmental monitoring for nuclear safeguards. — DIANE Publishing, 1995. — 45 с. — ISBN 1428920137, 9781428920132.
- ↑ 1 2 Can Reactor Grade Plutonium Produce Nuclear Fission Weapons? (англ.). Council for Nuclear Fuel Cycle Institute for Energy Economics, Japan (2001). Дата обращения: 5 сентября 2010. Архивировано 22 августа 2011 года.
- ↑ 1 2 3 4 John Holdren; Matthew Bunn. Types of Nuclear Bombs, and the Difficulty of Making Them (англ.). Nuclear Threat Initiative (25 ноября 2002). Дата обращения: 23 ноября 2010. Архивировано из оригинала 3 февраля 2012 года.
- ↑ Final Report, Evaluation of nuclear criticality safety data and limits for actinides in transport (англ.) (pdf). Institut de Radioprotection et de Sûreté Nucléaire. Дата обращения: 23 ноября 2010. Архивировано 22 августа 2011 года.
- ↑ Troubles tomorrow? Separated Neptunium 237 and Americium (англ.). Часть V. ISIS (1999). Дата обращения: 23 ноября 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ 1 2 A. Blanchard; K. R. Yates; J. F. Zino; D. Biswas; D. E. Carlson; H. Hoang; D. Heemstra. Updated Critical Mass Estimates for Plutonium-238 (англ.). U.S. Department of Energy: Office of Scientific & Technical Information. Дата обращения: 23 ноября 2010. Архивировано из оригинала 27 сентября 2011 года.
- ↑ 1 2 Amory B. Lovins. Nuclear weapons and power-reactor plutonium (англ.) // Журнал Nature : статья. — 1980. — Iss. 283, no. 5750. — P. 817—823. — doi:10.1038/283817a0. Архивировано 3 ноября 2012 года.
- ↑ 1 2 3 4 5 6 7 Плутоний. nuclear-weapons.nm.ru (2002). Дата обращения: 13 ноября 2010. Архивировано из оригинала 15 марта 2009 года.
- ↑ NMT Division Recycles, Purifies Plutonium-238 Oxide Fuel for Future Space Missions (англ.). Los Alamos National Laboratory (LANL) (26 июня 1996). Дата обращения: 22 декабря 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ Allen, R. P., Dahlgren, S. D., and Way, R. ref. 321 (англ.). — 1976. — P. 61.
- ↑ Bush, R. A. ref. 320 (англ.). — 1970. — P. 1037, 1045.
- ↑ Elliot, R. O., Geissen, B. C. ref. 321 (англ.). — 1976. — P. 47.
- ↑ Moody, Kenton James; Hutcheon, Ian D.; Grant, Patrick M. "plutonium+alloys"&cd=22#v=onepage&q=%22plutonium%20alloys%22 Nuclear forensic analysis. — CRC Press, 2005. — С. 169. — ISBN 0849315131.
- ↑ Hurst, D. G. and Ward, A. G. Canadian Research Reactors. — Los Alamos National Laboratory. (недоступная ссылка)
- ↑ Curro, N. J. Unconventional superconductivity in PuCoGa5. — Los Alamos National Laboratory, 2006. Архивировано 22 июля 2011 года.
- ↑ McCuaig, Franklin D. Pu-Zr alloy for high-temperature foil-type fuel. — 1977. Архивировано 13 февраля 2012 года.
- ↑ Jha, D.K. Nuclear Energy. — Discovery Publishing House, 2004. — С. 73. — ISBN 8171418848.
- ↑ 1 2 3 Plutonium / Авт. колл. — Taylor & Francis, 1967. — 1114 с.
- ↑ Вредные химические вещества. Радиоактивные вещества: Справ. изд. / В.А. Баженов, Л. А. Булдаков, И. Я. Василенко и др.; Под. ред. В. А. Филова и др.. — Л. : Химия, 1990. — С. 35, 206. — ISBN 5-7245-0216-X.
- ↑ 1 2 3 4 Пер. с англ. языка под ред. Б. А. Надыкто и Л. Ф. Тимофеевой. Плутоний. — Саров: РФЯЦ-ВНИИЭФ, 2003. — Т. 1. — 292 с. — (Фундаментальные проблемы). — 500 экз. — ISBN 5-9515-00-24-9.
- ↑ Dmitry S. Pesnya, Anton V. Romanovsky. Comparison of cytotoxic and genotoxic effects of plutonium-239 alpha particles and mobile phone GSM 900 radiation in the Allium cepa test (англ.) (pdf). Mutation Research/Genetic Toxicology and Environmental Mutagenesis (8 октября 2012). Дата обращения: 8 октября 2012. Архивировано 3 ноября 2012 года.
- ↑ H. Nagasawa, J.B. Littlea, W.C. Inkretb, S Carpenterc, K. Thompsonc, M.R. Rajuc, D.J. Chenc, G.F. Strnistec. Cytogenetic effects of extremely low doses of plutonium-238 alpha-particle irradiation in CHO K-1 cells (англ.). Mutation Research Letters (3 июля 1990). Дата обращения: 28 октября 2012. Архивировано 3 ноября 2012 года.
- ↑ 1 2 Weapons of Mass Destruction Архивная копия от 10 февраля 2015 на Wayback Machine // Britannica Educational Publishing, 2011, ISBN 1-61530-751-6, page 6
- ↑ 1 2 DOE contributors. Plutonium. Nuclear Safety and the Environment. Department of Energy, Office of Health Safety and Security. Дата обращения: 9 октября 2010. Архивировано из оригинала 22 января 2009 года.
- ↑ Лента.Ру. Впервые после холодной войны США возобновляют производство плутония. Лента.Ру (27 июня 2005). Дата обращения: 12 октября 2010. Архивировано 2 ноября 2012 года.
- ↑ Американские физики подтвердили открытие россиянами 114-го элемента. Lenta.ru (25 сентября 2009). Дата обращения: 18 ноября 2010. Архивировано 19 сентября 2011 года.
- ↑ Физики получили шесть новых изотопов сверхтяжёлых элементов. Lenta.ru (27 октября 2010). Дата обращения: 8 ноября 2010. Архивировано 11 января 2012 года.
- ↑ Chemical Element 114: One of Heaviest Elements Created (англ.). ScienceDaily Online (26 октября 2010). Дата обращения: 25 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ 3-я группа периодической системы — редкоземельные элементы, актиний и актиниды // Неорганическая химия. Химия элементов / Третьяков Ю. Д., Мартыненко Л. И., Григорьев А. Н., Цивадзе А. Ю. и др. — Уч. изд. — М.: "Химия", 2001. — Т. 1. — 472 с. — 1000 экз. — ISBN 5-7245-1213-0.
- ↑ Barber, R. C.; Greenwood, N. N.; Hrynkiewicz, A. Z.; Jeannin, Y. P.; Lefort, M.; Sakai, M.; Ulehla, I.; Wapstra, A. P.; Wilkinson, D. H. Discovery of The Transfermium Elements (англ.) // IUPAC : статья. — Великобритания, 1993. — Iss. 65, no. 8. — P. 1757—1814. — doi:10.1351/pac199365081757. Архивировано 9 февраля 2012 года.
- ↑ DOE contributors. Plutonium: The First 50 Years. — U.S. Department of Energy, 1996. Архивировано 18 февраля 2013 года. Архивированная копия. Дата обращения: 5 сентября 2010. Архивировано из оригинала 18 февраля 2013 года.
- ↑ 1 2 The atomic bombing of Nagasaki (англ.). The Manhattan Project (An Interactive History). US Department of Energy. Office of History and Heritage Resources. Дата обращения: 6 ноября 2010. Архивировано из оригинала 29 сентября 2006 года.
- ↑ "How many people died as a result of the atomic bombings?" (англ.) (яп.). Frequently Asked Questions. Radiation Effects Research Foundation (2007). Дата обращения: 6 ноября 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ Weapons research crosses the Channel (англ.) // Журнал Nature : статья. — Nature, 4 ноября 2010. — ISSN 0028-0836. — doi:10.1038/news.2010.583. Архивировано 5 ноября 2010 года.
- ↑ Isaac Asimov. Nuclear Reactors // Understanding Physics. — Barnes & Noble Publishing, 1988. — С. 905. — ISBN 0880292512.
- ↑ 1 2 Александр Емельяненков. Из плутония выпустят пар // "Российская газета" — Государство : статья. — Российская газета, 22 ноября 2007. — Вып. 4524. Архивировано 21 сентября 2011 года.
- ↑ [bse.sci-lib.com/article004689.html Взрыв]. Большая советская энциклопедия. Дата обращения: 18 декабря 2012. Архивировано 19 декабря 2012 года.
- ↑ Samuel Glasstone, Leslie M. Redman. An Introduction to Nuclear Weapons. — Atomic Energy Commission Division of Military Applications Report WASH-1038, 1972. — С. 12. Архивировано 27 августа 2009 года. Архивированная копия. Дата обращения: 5 сентября 2010. Архивировано из оригинала 27 августа 2009 года.
- ↑ Крючков, Игорь Этот сближающий атом. gzt.ru (27 октября 2009). Дата обращения: 23 октября 2010. Архивировано 3 октября 2015 года.
- ↑ Пузырев, Денис Южная Корея составила список целей для первоочередного удара на территории КНДР. gzt.ru (24 сентября 2009). Дата обращения: 23 октября 2010. Архивировано 2 октября 2015 года.
- ↑ Сергей Строкань. Обогащающие обстоятельства // Газета Коммерсантъ : статья. — Коммерсантъ, 2007. — Вып. 3643, № 67.
- ↑ Агентство Reuters. Пакистан наращивает ядерный потенциал // Коммерсантъ Новости : статья. — 2006. Архивировано 2 августа 2012 года.
- ↑ США и Казахстан объявили о закрытии ядерного реактора в Актау. ИТАР-ТАСС (17 ноября 2010). Дата обращения: 17 ноября 2010.
- ↑ США приветствуют закрытие ядерного реактора в Казахстане. РИА Новости (19 ноября 2010). Дата обращения: 4 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ GZT.RU (2009-09-26). "США и РФ подписали план утилизации российского плутония". gzt.ru. Архивировано из оригинала 2 октября 2015. Дата обращения: 23 октября 2010.
{{cite news}}: Неизвестный параметр|deadlink=игнорируется (|url-status=предлагается) (справка) - ↑ "Россия и США достигли успеха в перезагрузке". Вести.Ру. 2010-06-25. Архивировано из оригинала 30 октября 2010. Дата обращения: 29 октября 2010.
- ↑ Подписан закон о ратификации Соглашения между правительствами России и США об утилизации плутония, не являющегося более необходимым для целей обороны Архивная копия от 14 июня 2021 на Wayback Machine / kremlin.ru, 7 июня 2011
- ↑ kremlin.ru, Федеральный закон от 03.06.2011 г. № 108-ФЗ Архивная копия от 14 июня 2021 на Wayback Machine «О ратификации Соглашения между Правительством Российской Федерации и Правительством Соединённых Штатов Америки об утилизации плутония, заявленного как плутоний, не являющийся более необходимым для целей обороны, обращении с ним и сотрудничестве в этой области»
- ↑ 68 тонн плутония. От чего отказался президент Путин Архивная копия от 4 октября 2016 на Wayback Machine / Lenta.ru, 4 октября 2016
- ↑ Указ Президента Российской Федерации от 03.10.2016 № 511 Архивная копия от 3 октября 2016 на Wayback Machine «О приостановлении Российской Федерацией действия Соглашения между Правительством Российской Федерации и Правительством Соединённых Штатов Америки об утилизации плутония, заявленного как плутоний, не являющийся более необходимым для целей обороны, обращению с ним и сотрудничеству в этой области и протоколов к этому Соглашению»
- ↑ 1 2 P. Povinec, J. A. Sanchez-Cabeza. Radionuclides in the environment: International Conference on Isotopes in Environmental Studies: Aquatic Forum 2004, 25-29 October, Monaco. — Elsevier, 2006. — 646 с. — ISBN 0080449093, 9780080449098.
- ↑ Marshall Islands Research Could Lead to Resettlement After Nuclear Tests (англ.). ScienceDaily Online (12 февраля 2010). Дата обращения: 25 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Pierre Guéguéniat, Pierre Germain, Henri Métivier. Radionuclides in the oceans: inputs and inventories. — L'Editeur: EDP Sciences, 1996. — 231 с. — ISBN 2868832857, 9782868832856.
- ↑ Гордон Карера. 40 лет назад ВВС США потеряли атомную бомбу. bbcrussian.com (11 ноября 2008). Дата обращения: 3 декабря 2010. Архивировано 10 февраля 2015 года.
- ↑ Christensen, 2009, pp. 123—125.
- ↑ Тимошенко, Алексей (2009-10-28). "Роскосмос готовится к полётам на ядерном реакторе". gzt.ru. Архивировано из оригинала 3 октября 2015. Дата обращения: 23 октября 2010.
- ↑ Caldicott, Helen. The New Nuclear Danger: George W. Bush’s Military-Industrial Complex. — New York: The New Press, 2002.
- ↑ Thomas P. McLaughlin; Shean P. Monahan; Norman N. Pruvost; Vladimir V. Frolov; Boris G. Ryazanov; Victor I. Sviridov. A review of Critically Accidents (англ.) (pdf) 72, 82. Los Alamos National Laboratory (май 2000). — Обзор аварий, связанных с ядерными материалами. Дата обращения: 23 ноября 2010. Архивировано из оригинала 5 июля 2007 года.
- ↑ Антон Ефремов. Зона денежного отчуждения. УРА-Информ (25 ноября 2010). Дата обращения: 28 ноября 2010. Архивировано 23 декабря 2010 года.
- ↑ 1 2 Chernobyl’s Legacy: Health, Environmental and Socio-Economic Impacts (англ.) (pdf). The Chernobyl Forum: 2003—2005 (second revised version). International Atomic Energy Agency (IAEA). Дата обращения: 28 ноября 2010. Архивировано 22 августа 2011 года.
- ↑ МАГАТЭ. Energy, Electricity and Nuclear Power Estimates for the Period up to 2050 (англ.) // 30-е издание : отчёт, pdf. — Австрия, 2010. — P. 14, 18. — ISBN 978-92-0-108010-3. — ISSN 1011-2642. Архивировано 11 сентября 2011 года.
- ↑ Ed Gerstner. Nuclear energy: The hybrid returns (англ.) // Журнал Nature : статья. — 1 июля 2009. — Iss. 460. — doi:10.1038/460025a. Архивировано 20 декабря 2013 года.
- ↑ 1 2 Plutonium (англ.). Uses. Los Alamos National Laboratory's Chemistry Division (15 декабря 2003). Дата обращения: 30 декабря 2010. Архивировано 17 октября 2004 года.
- ↑ Ping Zhang, Bao-Tian Wang, Xian-Geng Zhao. Ground state properties and high pressure behaviour of plutonium dioxide: Systematic density functional calculations (англ.) (pdf). arxiv.org (3 мая 2010). Дата обращения: 16 ноября 2010.
- ↑ Venkateswara Sarma Mallela, V Ilankumaran, N.Srinivasa Rao. Trends in Cardiac Pacemaker Batteries (англ.) // Indian Pacing Electrophysiol J : статья. — 1 октября 2004. — Iss. 4, no. 4. Архивировано 29 августа 2023 года.
- ↑ Plutonium Powered Pacemaker (1974) (англ.). Oak Ridge Associated Universities (23 марта 2009). Дата обращения: 15 января 2011. Архивировано из оригинала 22 августа 2011 года.
- ↑ 1 2 А. М. Голуб. Общая и неорганическая химия = Загальна та неорганична хімія. — Киев: Вища школа, 1971. — Т. 2. — 416 с. — 6700 экз.
- ↑ Bayles, John J.; Taylor, Douglas. SEALAB III – Diver's Isotopic Swimsuit-Heater System (англ.). Department of Defense (1970). Дата обращения: 15 января 2011. Архивировано из оригинала 22 августа 2011 года.
- ↑ 1 2 3 4 Franklin H. Cocks. Energy demand and climate change: issues and resolutions. — Wiley-VCH, 2009. — 251 с. — ISBN 3527324461, 9783527324460.
- ↑ Andrew Wilson. Solar system log. — Лондон: Jane's Publishing Company Ltd, 1987. — С. 64. — 128 с. — ISBN 0710604440, 9780710604446.
- ↑ Константин Лантратов. Плутон стал ближе // Газета Коммерсантъ : статья. — Коммерсантъ, 2006. — Вып. 3341, № 10.
- ↑ Александр Сергеев. Зонд к Плутону: безупречный старт большого путешествия. — Элементы.Ру, 2006. Архивировано 13 апреля 2010 года.
- ↑ Тимошенко, Алексей Космическая эра — человек оказался не нужен. gzt.ru (16 сентября 2010). Дата обращения: 22 октября 2010. Архивировано 19 апреля 2010 года.
- ↑ Melissa McNamara. Space Probe Heads To Pluto - Finally (англ.). CBS News.com (19 января 2006). Дата обращения: 7 ноября 2010. Архивировано 20 августа 2011 года.
- ↑ Зонд New Horizons "оглянулся" на Юпитер. РИА Новости (28 июля 2010). Дата обращения: 4 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ "После сближения с Плутоном зонд New Horizons полетит в Пояс Койпера". Популярная Механика. 2014-10-16. Архивировано из оригинала 18 мая 2015. Дата обращения: 15 мая 2015.
- ↑ Энергия чистой науки: Ток из коллайдера // physics arXiv blog Популярная механика : статья. — 12.08.10. Архивировано 15 октября 2010 года.
- ↑ В NASA провели первый тест-драйв нового марсохода. Lenta.ru (26 июля 2010). Дата обращения: 8 ноября 2010. Архивировано 2 ноября 2012 года.
- ↑ Ajay K. Misra. Overview of NASA Program on Development of Radioisotope Power Systems with High Specific Power (англ.) // NASA/JPL : обзор. — San Diego, California, июнь 2006. Архивировано 9 августа 2012 года.
- ↑ Traci Watson. Troubles parallel ambitions in NASA Mars project (англ.). USA Today/NASA (14 апреля 2008). Дата обращения: 17 декабря 2010. Архивировано 3 февраля 2012 года.
- ↑ 1 2 Brian Dodson (2013-11-24). "NASA's cancellation of Advanced Sterling Radioisotope Generator casts doubt on future deep-space missions" (англ.). Gizmag.com. Архивировано из оригинала 18 мая 2015. Дата обращения: 15 мая 2015.
- ↑ "NASA отказалось от эффективного ядерного источника энергии". Популярная Механика. 2013-11-25. Архивировано из оригинала 24 сентября 2015. Дата обращения: 15 мая 2015.
- ↑ 1 2 Appolo 15. News. Press kit (англ.) (pdf) Стр. 57—58. NASA (National Aeronautics and Space Administration) (15 июля 1971). Дата обращения: 10 декабря 2010. Архивировано из оригинала 22 августа 2011 года.
- ↑ 1 2 Devision of Engineering. A Report of the NMAB. — 1-е изд. — National Academies, 1970. — 655 с.
- ↑ Lloyd I. Shure; Harwey J. Schwartz. Survey of Electric Power Plants for Space Applications (англ.) (pdf). NASA (декабрь 1965). Дата обращения: 25 декабря 2010. Архивировано 5 июня 2011 года.
- ↑ SNAP Power Generators, Except Satellites (англ.). RADNET. Дата обращения: 25 декабря 2010. Архивировано 3 февраля 2012 года.
- ↑ Planning & Human Systems, Inc. Atomic Power in Space. A History (англ.) (pdf) (март 1987). Дата обращения: 25 декабря 2010. Архивировано 3 февраля 2012 года.
- ↑ SNAP-21 Programm, Phase II (англ.) // Energy Citations Database : technical report. — США, 1 января 1968. — P. 149 с. — doi:10.2172/4816023.
- ↑ The Pioneer Jupiter Spacecraft (англ.). Electrical Power. NASA History Office (август 2004). Дата обращения: 25 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Appolo 17. News. Press kit (англ.) (pdf) Стр. 38—39. NASA (National Aeronautics and Space Administration) (26 ноября 1972). Дата обращения: 25 декабря 2010. Архивировано из оригинала 21 июля 2011 года.
- ↑ ALSEP Off-load (англ.). Appolo 12. Lunar Surface Journal (30 октября 2010). Дата обращения: 25 декабря 2010. Архивировано 22 августа 2011 года.
- ↑ Space FAQ 10/13 - Controversial Questions (англ.). faqs.org (29 июня 2010). Дата обращения: 25 декабря 2010. Архивировано 25 марта 2021 года.
- ↑ "Тепло Сарова для китайского «Зайца»". Редкие земли. 2014-04-16. Архивировано из оригинала 23 апреля 2014. Дата обращения: 19 апреля 2015.
- ↑ "Российские лунные станции будут работать на плутонии". ТАСС. 2014-11-27. Архивировано из оригинала 2 апреля 2015. Дата обращения: 19 апреля 2015.
- ↑ "Российские станции на Луне подпитаются от оружейного плутония". Lenta.ru. 2014-11-27. Архивировано из оригинала 11 февраля 2015. Дата обращения: 19 апреля 2015.
- ↑ "Озвучены детали российской лунной программы". Популярная механика. 2014-10-15. Архивировано из оригинала 18 мая 2015. Дата обращения: 15 мая 2015.
- ↑ Кесслер Г. Ядерная энергетика = Nuclear fussion reactors. Potential role and risks of converters and breeders / Пер. с англ. под ред. Митяев Ю. И. — М.: Энергоатомиздат, 1986. — 264 с. — 3700 экз.
- ↑ Марина Чадеева. Мирный атом: Ядерная энергетика. Популярная Механика (апрель 2005). Дата обращения: 3 января 2011. Архивировано 21 сентября 2011 года.
- ↑ Ф. И. Шаровар. Устройства и системы пожарной сигнализации. — М.: Стройиздат, 1979. — 271 с. — 20 000 экз.
- ↑ Дымоизвещатель РИД-1 на YouTube
- ↑ Извещатель дыма радиоизотопный РИД-6М. Паспорт еУ2.845.003 ПС.
- ↑ Plutonium Element Facts (англ.). Abundance & Isotopes. chemicool.com. Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
Литература править
- Испытания ядерного оружия и ядерные взрывы в мирных целях СССР 1949—1990 гг. : [рус.] : [арх. 7 февраля 2007]. — Саров : Министерство Российской Федерации по атомной энергии Министерство обороны Российской Федерации, РФЯЦ-ВНИИЭФ, 1996. — 66 с. — ISBN 5-85165-062-1.
- В.Ф. Перетрухин, А.М. Федосеев, Е.Б. Музрукова. Сибирский самородок. Анна Дмитриевна Гельман ("ru") // Итоги науки и техники : журнал. — 2009. — Ноябрь (№ 11). — С. 82—87.
- Монография «[1] Плутоний в девичьих руках».
Ссылки править
- На Викискладе есть медиафайлы по теме Плутоний
- На русском языке:
- Плутоний. Популярная библиотека химических элементов (14 октября 2003). Дата обращения: 11 октября 2010. Архивировано 22 августа 2011 года.
- И. Я. Василенко, О. И. Василенко. Плутоний (pdf) — 8 стр. — Воздействие плутония на организм. Дата обращения: 30 декабря 2010. Архивировано 22 августа 2011 года.
- На английском языке:
- Svend Aage Christensen. DIIS Report. The Marshal's baton. — Danish Institute of International Studies, 2009. — 278 p. — ISBN 9788776053314. Архивная копия от 27 сентября 2011 на Wayback Machine (англ.)
- The Criticality Safety Information Resource Center. A Review of Criticality Accidents: 2000 Revision (англ.). CSIRC. — Обзоры ядерных происшествий, в том числе связанных и с плутонием. Дата обращения: 23 ноября 2010. Архивировано из оригинала 29 сентября 2007 года.
- W. G. Sutcliffe, R. H. Condit, W. G. Mansfield, D. S. Myers, D. W. Layton, P. W. Murphy. A Perspective on the Dangers of Plutonium (англ.). Lawrence Livermore National Laboratory (14 апреля 1995). Дата обращения: 29 декабря 2010.
- Johnson, C. M.; Davis, Z. S. Nuclear Weapons: Disposal Options for Surplus Weapons-Usable Plutonium (англ.). CRS Report for Congress # 97-564 ENR (22 мая 1997). Дата обращения: 29 декабря 2010. Архивировано 7 марта 2021 года.
- Physical, Nuclear, and Chemical, Properties of Plutonium (англ.). IEER (июль 2005). Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
- Bhadeshia, H. Plutonium (англ.). University of Cambridge. — Кристаллография плутония. Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
- David Samuels. End of the Plutonium Age (англ.). Discover Magazine (22 ноября 2005). Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
- Pike, J.; Sherman, R. Plutonium Production (англ.). Federation of American Scientists (20 июня 2000). Дата обращения: 29 декабря 2010. Архивировано из оригинала 22 августа 2011 года.
- Plutonium Manufacture and Fabrication (англ.). Nuclearweaponarchive.org. Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
- Ong, C. World Plutonium Inventories (англ.). nuclearfiles.org (1999). Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
- Plutonium, Radioactive (англ.). NLM Hazardous Substances Databank. Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
- Annotated Bibliography on plutonium (англ.). Alsos Digital Library for Nuclear Issues. Дата обращения: 29 декабря 2010. Архивировано из оригинала 3 февраля 2009 года.
- Chemistry in its element (англ.) (mp3). Plutonium. Royal Society of Chemistry's Chemistry World. Дата обращения: 29 декабря 2010. Архивировано 22 августа 2011 года.
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист |
